

Simptomi bolesti: Rano u proleće, mogu biti inficirani mladi pupoljci koji potamne i osuše se. S proleća kada je vreme vlažno na lišću se može uočiti veća vodenasta pega koja nekrotira i sasuši se. Na lastarima siva trulež izaziva izbeljavanje kore. Najznačajniji su simptomi na bobicama koje su pokrivene sivom plesni.
Ciklus razvoja: Parazit prezimljava u obliku sklerocija u kori zaraženih lastara. S proleća, kada su obilne kišne padavine, konidije se razvijaju iz sklerocija i dolazi do zaraze lastara i grozdića koji uglavnom propadaju Veći procenat šećera u zrnu izaziva jaču pojavu bolesti, zbog toga je faza šarka posebno osetljiva.
Štetnost: Pojava simptoma rano u proleće na pupoljcima i lastarima dovodi do njihovog potpunog uništenja. Ipak najveće štete ovaj parazit pričinjava na bobicama, što utiče na smanjeni prinos i kvalitet groždja i slabijeg kvalitata vina.
Suzbijanje: Kritične fenološke faze za suzbijanje sive truleži (Botrytis cinereae) kada bi trebalo primeniti fungicide jesu:
- pri kraju faze cvetanja i zametanja bobica,
- kada se bobice počnu dodirivati,
- u fazi šarka (početak zrenja),
- 3-4 nedelje pred berbu groždja.
Od preparata za suzbijanje sive truleži mogu se primeniti: Cantus (1-1,2 kg/ha), Teldor 500-EC (0,1 %), Switch 62,5-WG (0,6/0,8 kg /ha), Folicur EM 50-WP (0,25 %), Ronilan DF (1kg/ha), Mythos, Botrystock (2,5 l/ha), Dional 500-SC (1 l/ha), Sumileks 50-FL, Bevemilex (1 l/ ha), Pehar (2 l/ha), Pyrus 400-SC (2.5 l/ha) i dr.
Prašna krastavost krompira (Spongospora subterranea)
Na površini krtola nalaze se plikovi u vidu bradavica. Dešava se da plikovi pucaju pri čemu nastaju kraste iz kojih se oslobadja crna prašna masa.
Hemijskim merama ovaj parazit se ne može suzbiti. Zbog toga, u ovom periodu preporučujemo proizvodjačima da vrše preglede magacinskog prostora i obavezo uklanjaju oštetežene krtole. Ove krtole treba uništiti, ne davati stoci za ishranu jer su spore vitalne i preko stajnjaka može doći do inficiranja zemljišta.
Mere zaštite:
Kako se bliži vreme naklijavanja krtola i njihove sadnje, ovako štećene krtole krompira ne treba koristiti za sadnju, a prilikom sadnje izbegavati vlažna i kisela zemljišta. Obavezan je petogodišnji plodored.
Sl.1. Prašna krastavost krompira (Spongospora subterranea)
Bakterijska trulež krompira (Erwinia carotovora subsp.caratovorum)
Obolelo tkivo krtola je meko, ulegnuto, sluzave i vlažne konzistencije. Tkivo se vremenom raspada, truli pri čemu se širi veoma neprijatan miris. Ovako zaražene krtole se na kraju pretvaraju u tamnu kašastu masu sa pojavom beličastog, penastog bakterijskog eksudata koji curi iz krtola.
Mere zaštite:
Obolele krtole odstraniti iz skladišnog prostora i obavezno uništiti, ne saditi ih.Temperatura u skadištu mora biti ispod 8°C,. Redovno provetravanje skladišnog prostora,.Provera zdravstvenog stanja krtola, posebno ako se čuvaju u vrećama, jer se bolest širi kontaktom.
Sl.2. Bakterijska trulež krompira (Erwinia carotovora subsp.caratovorum)
Suva trulež krtola krompira (Fusarium sp.)
Na mestima gde su krtole povređene, javljaju se sitne mrke zone. Infekcija se širi, tkivo iznad pega postaje vlažno i smežurava se, vrlo često u vidu koncentričnih krugova. Na tkivu koje je izumrlo javljaju se pustule sa micelijom i sporama gljiva beličaste nijanse. Napadnuti deo krtole je tamne boje, smežuran i postepeno uleže. Obolele krtole se sasušuju, smežuravaju i mumificiraju.Ovaj parazit prouzrokuje velike štete tokom skladištenja krompira. Infekcije se uglavnom ostvaruju u vreme vađenja krtola i pri transportu. Fusarium sp. se naročito brzo razvija sa porastom temperature u skladištu tokom ranog proleća.
Mere zaštite:
Smanjiti mogućnost povređivanja krtola prilikom vadnje krompira i njegovog uskladištenja. Prilikom skladiranja krompira obezbediti temperaturu iznad 12 stepeni i dobru ventilaciju kako bi se sprečila povećana vlažnost vazduha u cilju ubrzanog zarastanja povreda na krtolama. Dezinfekcija mehanizacije, skladišta i krtola,. Pravilno zarastanje isečenih krtola, Zaražene krtole treba odstraniti pre sadnje i baciti na smetlište.
Sl.3. Suva trulež krtola krompira (Fusarium sp.)
Plamenjača krtola krompira (Phytophthora infestans)
Na zaraženim krtolama nastaju nepravilne, tamnomrke pege, tkivo na preseku je vodenasto, tamne nijanse i zahvata 5-20 mm u dubinu krtole. Trulež se širi i nakon vadjenja krtola u skladištu. Zaražene krtole obično parazitiraju i neki drugi saprofitni mikroorganizmi koji prouzrokuju trulež neprijatnog mirisa. Krtole se teško čuvaju i obično brzo propadaju.
Mere zaštite:
S obzirom na to da zaraženi krompir predstavlja inokulum za dalje širenje bolesti, pre unošenja krtola u skladišni prostor (magacin, podrum…) preporučujemo obavezno uklanjanje obolelih krtola i njihovo uništavanje, kako se infekcioni potencijal ne bi unosio u skladišni prostor, pri čemu bi se zaražavale i zdrave krtole. Preporučuje se provetravanje skladišta i obavezno postavljanje zastora na otvore kako ne bi došlo do ulaska imaga moljca krompira koji bi polagao jaja na krtole u skladištu.
Sl. 4. 5 Zaražene krtole krompira od plamenjače (Phytophthora infestans)
Moljac krompira (Phthorimae operculella)
Jedna od češćih pojava jesu oštećenja na krtolama od strane moljca krompira (Phthorimae operculella). Oštećenja su plitko ispod površine krtole, ali mogu prodreti i duboko do unutrašnjosti. Tuneli koje izgrizu su dugi, lako se mogu primetiti i ispunjeni su izmetom gusenice. Po tome se mogu razlikovati od oštećenja od žičara ili grčica, najčešćih zemljišnih štetočina, koje prilikom ishrane ne ostavljaju izmet u unutrašnjosti krtola, a koje su takodje, registrovane na krtolama krompira. Tako oštećene krtole nemaju upotrebnu vrednost,vrlo brzo propadaju i ne preporučuju se za sadnju koja je na pragu.
Mere zaštite:
Preporuka proizvodjačima je obavezan zdravstveni pregled skladišnog prostora. Sve oštećene krtole ukloniti iz magacina i odložiti na odgovarajuće mesto. Ne koristiti ih za sadnju jer mogu pričiniti štete u nastupajućoj vegetacionoj sezoni. Potrebno je održavati higijenu u skladištu. Postavljati mrežice na prozorima i otvorima za ventilaciju skladišta čime se sprečava ulaz leptira U poslednje vreme primećuje se tendencija izgradnje hladnjača gde se u kontrolisanim uslovima, pri temperaturi od 4–9 0C čuva krompir, jer se pri temperaturi od 9 0Cprekida biološki ciklus razvića moljca krompira. U podrumima i podnim skladištima, ako je moguće, održavati temperaturu do 16 0C,pri kojoj nema piljenja gusenica iz jaja.
Sl. 5. Moljac krompora (Phthorimae operculella).
Za identifikaciju patogena u uslovima priručne laboratorije, mogu se primeniti opšte poznati testovi i metode, ali i neki modifikovani postupci, iz razloga nepostojanja kompletne laboratorijske opreme i tehnike rada (Arsenijević et al, 1994 b; Jovanović Gordana i Arsenijević, 1998 a,b; Arsenijević i Jovanović Gordana, 1997, 1998, 1999;):
Pri proveri patogenosti, moguće je izvršiti inokulacija lišća duvana i muškatle, inokulacija mladara jabuke, kruške i dunje, cvetova kruške i mladih, tek zametnutih, plodića kruške, kao i inokulacija nesazrelih plodova raznih sorti voćaka i drugih biljnih vrsta (kruške, jabuke, dunje, mušmule, šljive, kajsije, višnje, trešnje, džanarike, divlje kruške, gloga, japanske jabuke, japanske dunje, šipka i limuna),
Osim toga, mogu se inokulisati kriške plodova kruške i jabuke, mahune pasulja, plodovi paprike i kriške krompira (Arsenijević i Sremac Smiljana, 1993; Arsenijević, 1997). Proučeno je i ponašanje bakterija prema Gramu i serološki test aglutinacije na mikroskopskim pločicama
Testovi patogenosti
U uslovima priručne laboratorije postupak identifikacije patogena je skraćen, jer se ne obavlja izolovanje bakterije na hranljivoj podlozi, već se koristi bakterijski eksudat dobijen veštačkom inokulacijom nesazrelih plodića voćaka. Od tako dobijenog bakterijskog eksudata, pripremana je suspenzija bakterija koja je korišćena u daljem radu, kako pri proveri patogenosti, tako i kod bakterioloških testova: ponašanja bakterija prema Gramu i pri serološkom testu aglutinacije na mikroskopskim pločicama.
- Inokulacija lišća duvana i muškatle
Provera patogenosti na listovima duvana i muškatle obavljena je ubrizgavanjem suspenzije bakterija, dobijene korišćenjem bakterijskog eksudata formiranog na nesazrelim plodićima, prethodno inokulisanim česticama obolelog tkiva voćaka. Inokulacija je vršena medicinskim špricem ubrizgavanjem suspenzije bakterija u lisno tkivo (Arsenijević i Jovanović Gordana, 1999).
Inokulisane biljke su održavane u uslovima sobne temperature 24 časa, posle čega je utvrđivana pojava nekrotičnih promena, odnosno pojava hipersenzibilnosti ovih biljaka. Inokulacija lišća duvana i muškatle vodom korišćena je kao negativna kontrola.
- Inokulacija lišća duvana i muškatle
U uslovima priručne laboratorije izvršena je inokulacija lišća duvana i muškatle. Nakon 24 časa od inokulacije, medicinskim špricem, korišćenjem suspenzije bakterija, poreklom od eksudata sa prethodno inokulisanih plodića, (izvršenim pomoću nekrotičnog tkiva obolelih voćaka) dolazi do nekrotičnih promena, odnosno pojave hipersenzibilne reakcije, što ukazuje na moguće prisustvo patogene bakterije E. amylovora ili P. s. pv. syringae. Prilikom inokulacije lišća duvana i muškatle vodom ne uočavaju se nikakve promene.
- Inokulacija mladara jabuke, kruške i dunje
Provera patogenosti je obavljena i inokulacijom mladara jabuke sorte ajdared, kruške sorte butira i dunje sorte leskovačka. Inokulacija je vršena nanošenjem suspenzije bakterija, dobijene korišćenjem bakterijskog eksudata (poreklom sa plodića prethodno inokulisanog nekrotičnim tkivom), ubodom mladara pomoću igle na nekoliko mesta u čvrsto tkivo mladara ili njegov zeljasti deo.
Posle inokulacije, mladari su isprskani vodom i postavljani u vlažnu komoru 2-3 dana, a zatim su održavani u uslovima sobne temperature. Rezultati su očitavani posle 3, 5, 7, 10 i 15 dana od inokulacije. Kontrolni mladari jabuke, kruške i dunje su tretirani istim postupkom, ali umesto suspenzije korišćena je voda.
-Inokulacija mladara jabuke, kruške i dunje
Na mladarima jabuke sorte ajdared, kruške sorte butira i dunje sorte leskovačka, inokulisanih ubodom i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, dolazi do pojave nekroze oko mesta uboda posle 3-4 dana od inokulacije. Narednih nekoliko dana nastaje nekroza vrha mladara, koji se često kukasto povija. Za oko 12 dana ceo mladar vene i izumire. Na kontrolnim mladarima inokulisanim vodom ne uočavaju se nikakve promene.
- Inokulacija cvetova kruške i mladih tek zametnutih plodića kruške
Inokulacija cvetova kruške sorte santa marija, obavljena je nanošenjem kapi suspenzije bakterija (dobijene korišćenjem bakterijskog eksudata poreklom sa plodića inokulisanih nekrotičnim tkivom), na žig tučka i prašnike, a inokulacija tek zametnutih plodića kruške sorte santa marija nanošenjem suspenzije bakterija ubodom igle u tkivo mladih, tek, zametnutih plodića.
Nakon inokulacije, mladari sa inokulisanim cvetovima, i tek formiranim plodićima, postavljani su u vlažnu komoru 2-3 dana, a zatim prenošeni u uslove sobne temperature. Rezultati su očitavani posle 3, 5, 7, 10 i 15 dana. Inokulacija cvetova kruške i mladih tek zametnutih plodića kruške vodom korišćena je kao negativna kontrola.
- Inokulacija cvetova kruške i mladih tek zametnutih plodića kruške
Na cvetovima kruške sorte santa marija, 2-3 dana posle inokulacije prskanjem i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, primećuju se prve nekrotične promene na čašici cveta gde je izvršena inokulacija. Narednih dana nekroza se širi, tako da se posle 5-7 dana od inokulacije uočava nekroza cvetova i cvetne drške, koji pocrne i izumiru.
Nakon inokulacije mladih, tek zametnutih plodića kruške sorte santa marija ubodom u tkivo ploda, najpre se primećuje nekrotična zona oko mesta inokulacije na plodiu, a nakon 7 dana nastaje nekroza i izumiranje ploda i drške plodića. Infekcija se dalje širi, tako da patogen parazitira lišće i mladar, koji nekrotiraju i suše se zajedno sa plodićima. Na kontrolnim cvetovima i mladim, tek zametnutim plodićima kruške, inokulisanim vodom, ne uočavaju se nikakve promene.
- Inokulacija nesazrelih plodova raznih sorti voćaka i drugih biljnih vrsta
Za veštačku inokulaciju nesazrelih plodova korišćeno je vi{še raznih vrsta i sorti biljaka, kako bi se utvrdilo koja od njih najbrže reaguje pojavom nekroze i stvaranjem bakterijskog eksudata (tab. 7). Testirani su plodići sledećih vrsta i sorti biljaka: kruška (Pyrus domestica Medicus.) - sorte: viljamova, kaluđerka, pasakrasan i santa marija; jabuka (Malus domestica Borkh.) - sorte: ajdared i spergold; dunja (Cydonia oblonga Mill.) - sorta: leskovačka; mušmula (Mespilus germanica L.) - domaća mušmula; šljiva (Prunus domestica L.) - sorta: stenli; kajsija (Prunus armeniaca L.) - sorta: mađarska najbolja; višnja (Prunus cerasus L.) - ekotip: oblačinska (izdvojen iz spontane populacije); trešnja (Prunus avium L.) - sorte: stela i germerdorfska; đanarika (Prunus cerasifera Ehrh.); divlja kruška (Pyrus piraster Burgs.); glog (Crataegus monogyna Jacq.); japanska jabuka (Diospyros kaki L.); japanska dunja (Chaenomeles japonica (Thunb.) Lindl.); šipak (Rosa canina L.); i limun (Citrus limonum Risso.).
Inokulacija mladih, nesazrelih plodića je obavljena nanošenjem kapi suspenzije bakterija, ubodom igle na po tri mesta u tkivo plodića (u vidu trougla). Potrebna suspenzija bakterija je dobijena korišćenjem bakterijskog eksudata formiranog na nesazrelim plodićima šljive (prethodno inokulisanim), unošenjem nekrotičnih čestica (uzetih sa tkiva obolelih voćaka) u tkivo plodova, ili upotrebom macerata. Inokulisani plodići su održavani u vlažnoj komori 1-2 dana, a potom postavljani na laboratorijske stolove, pri uslovima sobne temperature. Rezultati su očitavani posle 2 do 12 dana od inokulacije (Arsenijević et al., 1994 c; Arsenijević i Jovanović Gordana, 1997, 1999). Kontrolni, nesazreli plodići tretirani su vodom.
Inokulacija nesazrelih plodova raznih voćaka i drugih vrsta biljaka u priručnoj laboratoriji
Provera patogenosti je obavljena inokulacijom raznih sorti nesazrelih plodova kruške, jabuke, dunje, mušmule, šljive, kajsije, višnje, trešnje, zatim djanarike, divlje kruške, gloga, japanske jabuke, japanske dunje, šipka i limuna, ubodom igle (tab. 1). Korišćena je suspenzija bakterija poreklom od eksudata sa prethodno inokulisanih plodića upotrebom macerata, dobijenog gnječenjem nekrotičnog tkiva. U tab. 7 prikazano je vreme pojave nekrotičnih promena i formiranja kapi bakterijskog eksudata na inokulisanim plodićima raznih biljnih vrsta korišćenih u našim istraživanjima.
Tab.1. Vreme pojave nekrotičnih promena i formiranja kapljica bakterijskog eksudata na inokulisanim plodićima raznih vrsta biljaka
|
Vrsta Species |
Sorta Cultivar |
Nekrotične promene (posle dana) Tissue necrosis (after days) |
Bakterijski eksudat (posle dana) Bacterial exudate (after days) |
Patogen Pathogen |
|
Kruška Pear |
Pasakrasana Passa crassana Viljamova William*s pear Kalu|erka “Kaludjerka” Santa Marija Santa Maria |
2-3 |
3-4 |
|
|
Jabuka Apple |
Ajdared Idared Spergold Goldspur |
4-5 |
7-10 |
|
|
Dunja Quince |
Leskovačka Leskovac variety Vranjska Vranje variety |
7 |
10-12 |
|
|
Mušmula Medlar |
Domaća Domestic variety |
7-10 | 12-13 | |
|
Šljiva Plum |
Stenli Stanley |
1-2 | 2-3 | Erwinia |
|
Kajsija Apricot |
Ma|arska najbolja Hungarian the best |
2-3 |
7-10 |
amylovora |
|
Višnja Sour-cherry |
Oblačinska Oblačinska variety |
5-6 | 13 | |
|
Trešnja Cherry |
Stela Stella Germerdorfska Germerdorf |
4-5 - |
7 - |
|
|
Đanarika “D`anarika” - Plum |
2-3 |
4 |
||
|
Divlja kruška Wild pear |
2 | 2-3 | ||
|
Glog Hawthorn |
2-3 | 3-4 | ||
|
Japanska jabuka Japanese apple |
2-3 |
4-5 |
||
|
Japanska dunja Japanese quince |
5-7 |
9-10 |
||
|
Šipak Hip |
7-8 | 12-13 | ||
|
Limun Lemon |
1-2 | - |
P.syringae pv. syringae |
- Inokulacija kriški plodova kruške i jabuke
Inokulacija preseka plodova kruške sorte pasakrasan i jabuke sorte spergold, obavljena je prelivanjem suspenzije bakterija, dobijene korišćenjem bakterijskog eksudata formiranog na prethodno inokulisanim plodićima voćaka, preko preseka plodića, medicinskim špricem (Arsenijević i Jovanović Gordana, 1999).
Nakon inokulacije, delovi plodića su postavljani u Petri kutije sa navlaženim filter papirom, a ove u vlažnu komoru 1-2 dana. Potom su iznete na laboratorijske stolove, pri uslovima sobne temperature. Rezultati su očitavani posle 3, 5 i 7 dana od inokulacije (Billing et al., 1960; Panić i Arsenijević, 1996). Kontrolne kriške plodova kruške i jabuke tretirane su vodom.
- Inokulacija nesazrelih plodova kruške
Prilikom veštačke inokulacije nesazrelih plodova kruške sorti: viljamova, kaluđerka, santa marija i pasakrasan, 2-3 dana nakon inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, primećuju se nekrotične pege oko mesta uboda, a posle 3-4 dana pojavljuju se kapljice bakterijskog eksudata beličaste boje. Narednih dana stvaranje eksudata je obilnije, a njegova boja je tamnija. Za oko nedelju dana plod potpuno nekrotira i pocrni (tab. 7). Pri inokulaciji raznih sorti plodova kruške, nema razlike u pogledu vremena formiranja kapi bakterijskog eksudata (tab. 7). Na kontrolnim plodićima koji su inokulisani vodom ne uočava se nikakva promena na pokožici ploda.
-Inokulacija nesazrelih plodova jabuke
Na nesazrelim plodovima jabuke sorti: ajdared i spergold, nakon 4-5 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, pojavljuje se nekroza pokožice ploda, a posle 7-10 dana uočava se pojava bakterijskog eksudata u vidu izuzetno finih i sitnih kapi beličaste boje (tab. 7). Kod jabuke sorti: ajdared i spergold nema razlike u pogledu vremena formiranja kapi bakterijskog eksudata. Na kontrolnim plodićima jabuke inokulisanim vodom ne uočavaju se nikakve promene.
-Inokulacija nesazrelih plodova dunje
Na nesazrelim plodovima dunje sorti: vranjska i leskovačka, tek nakon 7 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, uočavaju se nekrotične promene na pokožici plodića, a nakon 10-12 dana formiraju se sitne, fine kapi bakterijskog eksudata beličaste boje (tab. 7.). Kod plodova dunje sorti: vranjska i leskovačka, nema razlike u vremenu formiranja kapi bakterijskog eksudata. Na kontrolnim plodićima inokulisanim vodom ne uočavaju se nikakve promene.
-Inokulacija nesazrelih plodova mušmule
Na inokulisanim nesazrelim plodićima domaće mušmule prve nekrotične promene oko mesta uboda, izvrššenog ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, primećuju se 7-10 dana od inokulacije. Nakon 12-13 dana pojavljuje se bakterijski eksudat boje meda, ispoljen u vidu finih, sitnih kapi oko mesta inokulacije (tab. 7). Na kontrolnim plodićima inokulisanim vodom ne uočavaju se nikakve promene.
- Inokulacija nesazrelih plodova šljive
Na inokulisanim plodićima šljive sorte stenli, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, prve promene ispoljene u vidu nekrotičnih zona oko mesta uboda pojavljuju se već posle 24-48 sati. Istovremeno, ili nešto kasnije, uočavaju se sitne beličaste kapi bakterijskog eksudata formirane oko mesta gde je izvršena inokulacija ili nešto dalje po površini plodića. Narednih dana formiranje eksudata je izraženije. Tokom sedam dana plodić potpuno nekrotira i pocrni (tab.7.). Na kontrolnim plodićima šljive inokulisanim vodom ne zapažaju se nikakve promene.
- Inokulacija nesazrelih plodova kajsije
Na nesazrelim plodovima kajsije sorte mađarska najbolja, nakon 2-3 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, uočavaju se nekrotične promene preko cele površine plodića, a nakon 7-10 dana od inokulacije dolazi do formiranja kapljica bakterijskog eksudata, beličastokrem boje, po celoj površini plodića (tab. 7.). Na kontrolnim plodićima inokulisanim vodom ne uočavaju se nikakve promene.
- Inokulacija nesazrelih plodova višnje
Na inokulisanim plodovima višnje, ekotip oblačinska, nakon 5-6 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, pojavljuju se nekrotične promene oko mesta uboda. Narednih dana nekrotični proces se širi, da bi nakon 10-12 dana cela površina plodića nekrotirala i dobila tamnomrku boju. Tek posle 13 dana primećuju se jako sitne beličaste kapi bakterijskog eksudata oko mesta inokulacije (tab. 7). Na kontrolnim plodićima inokulisanim vodom ne uočavaju se nikakve promene.
- Inokulacija nesazrelih plodova trešnje
Obavljena je inokulacija sorti: stela i germerdorfska, pri čemu je reakcija plodića različita. Na plodovima trešnje sorte stela nakon 4-5 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića maceratom, pojavljuju se nekrotične promene oko mesta uboda, a posle 7 dana primećuju se beličaste kapi bakterijskog eksudata u delu gde nekrotira pokožica ploda. Nakon toga, dolazi do potpunog nekrotiranja plodića, koji dobija tamnomrku boju, a istovremeno se uočava i obilno formiranje eksudata beličaste boje. Eksudat se najpre nalazi oko mesta inokulacije, a potom se spaja i sliva u vidu krupne beličaste kapi (tab. 7). Istovremeno, primećuje se destrukcija ploda, koji dobija neravnu, grubu površinu. Na plodićima trešnje sorte germerdorfska i na kontrolnim plodićima koji su inokulisani vodom, nije primećena nikakva promena na pokožici plodića.
- Inokulacija nesazrelih plodova đanarike
Na nesazrelim plodovima đanarike, nakon 2-3 dana od inokulacije, ubodom igle i korišenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića maceratom primećuje se nekrotična promena pokožice plodića, a posle 4 dana dolazi do pojave sitnih i finih kapi bakterijskog eksudata beličaste boje, u predelu gde pokožica ploda nekrotira (tab. 7). Na kontrolnim plodićima inokulisanim vodom ne zapažaju se nikakve promene.
- Inokulacija nesazrelih plodova divlje kruške
Prilikom veštačke inokulacije nesazrelih plodova divlje kruške, ubodom igle i korišćenjem suspenzije bakterija, poreklom od eksudata sa prethodno inokulisanih plodića maceratom prve promene u vidu nekroze oko mesta uboda, primećuju se nakon 2 dana od inokulacije, a posle 3 dana zapaža se pojava beličastih kapi bakterijskog eksudata oko mesta inokulacije (tab. 7). Na inokulisanim kontrolnim plodićima divlje kruške ne uočavaju se nikakve promene.
- Inokulacija nesazrelih plodova gloga
Na nesazrelim plodovima gloga, nakon 2-3 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija, poreklom od eksudata sa prethodno inokulisanih plodića maceratom, uočava se razvoj nekrotičnih promena oko mesta uboda. Istovremeno, ili nešto kasnije, dolazi do formiranja kapljica bakterijskog eksudata. Nekroza se postepeno širi, tako da za 7 dana plod potpuno nekrotira i pocrni (tab. 7). Na kontrolnim plodićima inokulisanim vodom ne uočavaju se nikakve promene.
- Inokulacija nesazrelih plodova japanske jabuke
Na nesazrelim plodovima japanske jabuke, nakon 2-3 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija, poreklom od eksudata sa prethodno inokulisanih plodića, primećuje se nekroza pokožice ploda, kao i nekroza peteljke i čašice plodića. Sledećeg dana oni se odvajaju od plodića i otpadaju, a sa unutrašnje strane čašičnih listića koji su potpuno nekrotirali, pojavljuju se krupne žućkaste kapi bakterijskog eksudata. Istovremeno i površina plodića potpuno nekrotira, dobija tamnomrku boju, a nakon 4-5 dana primećuju se beličastožućkaste kapi bakterijskog eksudata (tab. 7). Na kontrolnim plodićima inokulisanim vodom ne uočavaju se nikakve promene.
- Inokulacija nesazrelih plodova japanske dunje
Na nesazrelim plodovima japanske dunje, nakon 5-7 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, uočavaju se nekrotične promene po površini plodića. Pojava kapljica bakterijskog eksudata beličaste do svetlonaranđaste boje, uočava se 9-10 dana od inokulacije (tab. 7).
Isto tako, na plodićima japanske dunje nekada se uočava pojava beličastih, vrlo sitnih kapi bakterijskog eksudata po površini plodića (nakon 9 dana od inokulacije), a već sledećeg dana primećuje se nekroza pokožice ploda u predelu gde se nalazi eksudat. Na kontrolnim plodićima inokulisanim vodom ne zapažaju se nikakve promene.
- Inokulacija nesazrelih plodova šipka
Na nesazrelim plodovima šipka tek nakon 7-8 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, dolazi do nekrotičnih promena oko mesta uboda, a posle 12-13 dana pojavljuju se kapi bakterijskog eksudata boje meda (tab. 7). Na kontrolnim plodićima inokulisanih vodom ne uočavaju se nikakve promene.
- Inokulacija plodova limuna
Prilikom inokulacije nesazrelih plodova limuna, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata, ne uočavaju se nikakve promene na plodićima. Suprotno tome, bakterija P. syringae pv. syringae prouzrokuje pojavu nekrotičnih zona oko mesta uboda. Plodovi limuna, inače se preporučuju za identifikaciju ovog patogena (Psallidas i Dimova, 1986; Arsenijević, 1992; Arsenijević i Sremac Smiljana, 1993). Na kontrolnim plodovima limuna inokulisanih vodom, nisu uočene nikakve promene.
- Inokulacija kriški plodova kruške i jabuke
Inokulacijom kriški plodova kruške sorti: pasakrasan i kaluđerka, prelivanjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića maceratom do pojave kapi bakterijskog eksudata dolazi posle 3 dana. Narednih dana stvaranje eksudata je obilnije, tako da posle 6 dana bakterijski eksudat preliva celu površinu preseka kruške.
Na inokulisanim kriškama jabuke sorte spergold, dolazi do nekrotičkih procesa, odnosno pojave svetlo do tamnomrke boje mezokarpa plodića. Nakon 7 dana od inokulacije primećuju se na preseku ploda jabuke pojedinačne kapi bakterijskog eksudata i blagi preliv, jedva vidljiv na mezokarpu plodića. Na kontrolnim kriškama plodova kruške i jabuke inokulisanim vodom, ne uočavaju se nikakve promene.
- Inokulacija mahuna pasulja, plodova paprike i krtola krompira
Nesazrele mahune pasulja i plodovi paprike su inokulisani medicinskim špricem ubrizgavanjem suspenzije bakterija, dobijene korišćenjem bakterijskog eksudata formiranog na prethodno inokulisanim plodićima voćaka.
Inokulisane mahune pasulja i plodovi paprike su postavljani u vlažne komore, a 48 sati posle inokulacije izloženi uslovima sobne temperature (Arsenijević, 1988, 1992; Arsenijević et al., 1992; Arsenijević i Sremac Smiljana, 1993).
Inokulacija kriški krompira je obavljena premazom suspenzije bakterija preko preseka kriške. Ovako inokulisane kriške postavljane su u Petri kutije sa navlaženim filter papirom, a očitavanje rezultata je vršeno 3, 5 i 7 dana posle inokulacije. Tretiranje mahuna pasulja, plodova paprike i kriški krompira vodom je korišćeno kao kontrola.
- Inokulacija mahuna pasulja, plodova paprike i kriški krompira
Na mahunama pasulja inokulisanim suspenzijom bakterija poreklom od eksudata sa prethodno inokulisanih plodića, dolazi do pojave svetlomrkih pega, koje ne uležu u tkivo, što ukazuje na prisustvo E. amylovora, dok se prisustvo P. syringae pv. syringae ispoljava formiranjem ulegnutih, nekrotičnih pega na inokulisanim mahunama.
Na plodovima paprike, nakon inokulacije sa E. amylovora ne dolazi ni do kakvih promena, što ukazuje na odsustvo ove bakterije u maceriranom tkivu, dok u slučaju prisustva P. syringae pv. syringae na inokulisanim plodovima paprike nastaje nekroza tkiva oko mesta uboda, koja se vremenom širi i povećava. Na inokulisanim kriškama krompira nisu utvrđene nikakve promene. Kod kontrolnih mahuna pasulja, plodova paprike i kriški krompira inokulisanih vodom, ne uočavaju se nikakve promene.
Primena specifičnih testova identifikacije patogena u priručnoj laboratoriji
- Ponašanje bakterija prema Gramu
Ponašanje bakterija prema Gramu, u uslovima priručne laboratorije, proučeno je primenom 3% KOH, tako što se na mikroskopsku pločicu nanosi kap 3% KOH a zatim pomoću čačkalice za zube uzme jedan zahvat bakterijskog eksudata formiranog na plodiću inokulisanog suspenzijom bakterija ili fragmentom nekrotičnog tkiva. Zatim se obe kapi čačkalicom dobro homogenizuju. Podizanjem čačkalice 1-2 cm uvis iznad mikroskopske pločice, uz pojavu niti ili „končića“ dokazuje se prisustvo gramnegativnih bakterija (Arsenijević i Jovanović Olivera, 1995 i Arsenijević i Jovanović Gordana, 1997, 1999).
- Ponašanje bakterija prema Gramu
Pokazalo se da se ovaj test može izvesti, kako u opremljenim bakteriološkim laboratorijama, tako i u uslovima priručne laboratorije. Prilikom homogenizacije kapi 3% KOH i kapi bakterijskog eksudata poreklom sa prethodno inokulisanih plodića voćaka maceratom nekrotičnog tkiva dolazi do formiranja “končića”, odnosno fine vidljive niti, koja predstavlja znak gramnegativnog ponašanja bakterija uopšte uzev, a u našem slučaju bakterije E. amylovora.
- Serološki test aglutinacije na mikroskopskim pločicama
Serološki test aglutinacije na mikroskopskim pločicama je izveden korišćenjem antiseruma E. amylovora proizvedenog u našoj zemlji pomoću autentičnog soja bakterije E. amylovora 1430 (poreklom iz Francuske), koji je postojao u kolekciji bakterija prof. M. Arsenijevića na Poljoprivrednom fakultetu u Novom Sadu. Antiserum bakterije E. amylovora, laboratorija Zavoda u Leskovcu je dobila posredstvom prof. M. Arsenijevića.
Test je primenjen uobičajenim postupkom, s tom razlikom što se ovde, umesto kulture E. amylovora koristi bakterijski eksudat sa plodića prethodno inokulisanog obolelim tkivom i nanosi na mikroskopsku pločicu (Arsenijević i Jovanović Gordana, 1997, 1999).
Kap nanetog antiseruma i bakterijski eksudat se na pločici dobro homogenizuju mešanjem pomoću čačkalice za zube. Pojava sitnih, peskovitih čestica u vidu pahuljastog taloga znak je aglutinacije.
- Serološki test aglutinacije na mikroskopskim pločicama
U uslovima priručne laboratorije uspešno je izveden i test aglutinacije na mikroskopskim pločicama, gde nakon mešanja kapi antiseruma i kapi bakterijskog eksudata poreklom sa prethodno inokulisanih plodića voćaka maceratom nekrotičnog tkiva dolazi do stvaranja pahuljastog taloga, što predstavlja znak prisustva bakterije E. amylovora.
DISKUSIJA
Vizuelna dijagnoza bakteriozne plamenjače vošaka, koju prouzrokuje E. amylovora, ne mora uvek biti pouzdana i tačna. Jer, simptome nalik ovoj bolesti, koji se uočavaju na terenu, mogu prouzrokovati i neki drugi agensi biotske i abiotske prirode (van der Zwet i Keil, 1979; Kudela, 1990; van der Zwet i Beer, 1991; Panić i Arsenijević 1996; Jovanović Gordana, 1999). Zbog toga je identifikacija patogena u fitobakteriološkim laboratorijama namenjenim za tu svrhu, i najpouzdanija.
Istovremeno sa proučavanjem ponašanja izolata bakterije u fitopatološkim laboratorijama, vršena su i uporedna proučavanja patogena u priručnoj laboratoriji. Zato je od uzoraka obolelih biljaka prikupljenih sa terena, jedan deo dostavljan Fakultetu i Institutu, a drugi deo je ostavljan radi proučavanja u priručnoj laboratoriji Zavoda.
Ispostavilo se, međutim, da osim u bakteriološkim laboratorijama fakulteta i instituta, uspešna identifikacija E. amylovora se može obaviti i u uslovima priručne laboratorije na terenu, primenom ustaljenih i nekih modifikovanih postupaka (tab. 1) (Arsenijević i Jovanović Gordana, 1997,1999; Jovanović Gordana 1999), primenjenih tokom ovih istraživanja u Zavodu za poljoprivredu „Leskovac” u Leskovcu, jer su dobijeni rezultati o ponašanju bakterije, korišćenjem osnovnih testova identifikacije gotovo identični.
U fitobakteriološkim laboratorijama fakulteta i instituta izvršeno je izolovanje bakterije na mesopeptonskoj (MPP) i mesopeptonskoj podlozi obogaćenoj s 5% saharoze (NAS) (sl. 1). Pri tome je izolovano 154 soja bakterija, od čega je 104 imalo odlike bakterije E. amylovora, a 18 sojeva odlike P.s.pv.syringae. (tab. 2-6). Takođe su izolovani sojevi koji verovatno ukazuju na karakteristike saprofitske bakterije E. herbicola i predstavnici Pseudomonas sp. (Billing et al., 1960; Psallidas i Dimova, 1986; Lelliott i Stead, 1987; Mitrev, 1993, 1995; Arsenijević i Mitrev, 1995; Panić i Arsenijević, 1996; Gavrilović, 1998).
Morfološke, odgajivačke i patogene odlike izlovanih sojeva E. amylovora poreklom s obolelih stabala kruške, jabuke, dunje, mušmule, divlje kruške, gloga, sadnica jabuke i matičnih stabala kruške u potpunosti se podudaraju sa podacima iz literature (Billing et al., 1960; van der Zwet i Keil, 1979; Psallidas i Dimova, 1986; Lelliott i Stead, 1987; Panić et al., 1994 i dr).
U uslovima priručne laboratorije Zavoda za poljoprivredu „Leskovac” u Leskovcu, uspešno su primenjeni testovi patogenosti i to: inokulacija lišća duvana i muškatle, inokulacija mladara jabuke, kruške i dunje, cvetova kruške i mladih, tek formiranih plodića kruške, inokulacija nesazrelih plodića raznih sorti voćaka i drugih biljnih vrsta, reakcija po Gramu, serološki test aglutinacije na mikroskopskim pločicama, kao i inokulacija mahuna pasulja, plodova paprike i kriški krompira. Ove testove u cilju provere patogenosti i identifikacije E. amylovora ističu mnogi autori (Billing et al., 1960; van der Zwet i Keil, 1979; Psallidas i Dimova, 1986; Arsenijević, 1992, 1997; Arsenijević et al., 1994c; Panić i Arsenijević 1996).
Za sve ove testove upotrebljena je suspenzija bakterija, pripremljena korišćenjem bakterijskog eksudata proizvedenog veštačkom inokulacijom nesazrelih plodića voćaka, česticama nekrotičnog tkiva prirodno inficiranog, jer se ne vrši izolovanje bakterije na hranljivoj podlozi (Arsenijević i Jovanović Gordana, 1997, 1999).
U tome je i osnovna razlika u proučavanju ponašanja bakterije primenom osnovnih testova identifikacije, jer je u fitobakteriološkim laboratorijama umesto bakterijskog eksudata, korišćena suspenzija bakterija pripremljena od kultura, razvijenih na hranljivoj podlozi.
Prilikom provere patogenosti sojevi E. amylovora i P. syringae pv syringae ispoljavaju isti tip promena na inokulisanim listovima duvana i muškatle, mladarima jabuke, kruške i dunje, cvetovima kruške i mladim, tek zametnutim plodićima kruške. Zbog toga je inokulacija nesazrelih plodića voćaka poslužila kao osnovni diferencijalni test, jer pojava nekrotičnih zona sa kapima bakterijskog eksudata nedvosmisleno ukazuje na prisustvo E. amylovora. Zato je u uslovima priručne laboratorije ovaj test detaljnije proučen, kada je obavljena inokulacija više raznih vrsta i sorti voćaka sa različitim vremenom sazrevanja tokom vegetacije.
Inokulaciju nesazrelih plodića voćaka (šljive, kruške, kajsije, jabuke, trešnje i dr.), kao pouzdani i brzi test provere patogenosti ističu mnogi autori (Billing et al., 1960; Psallidas i Dimova, 1986; Mitrev, 1993; Arsenijević et al., 1994c; Panić i Arsenijević, 1996). Naši autori izvesnu prednost daju plodićima šljive sorte stenli (Mitrev, 1993; Arsenijević et al., 1994c; Panić i Arsenijević, 1996). Ali su i plodići kruške (Billing et al., 1960; Psallidas i Dimova, 1986; Arsenijević et al., 1994c) vrlo pogodni za proveru patogenosti E. amylovora, što se podudara s našim rezultatima (tab. 7). Billing et al. (1960) napominju da su kriške kruške izuzetno pogodne za proveru patogenosti, što potvrđuju i naši rezultati, jer je test vrlo jednostavan, efikasan i brz.
Prema nekim rezultatima dobijenim u našoj zemlji, plodići trešnje sorte Sue pogodniji su za inokulaciju od plodića kruške (Arsenijević et al., 1994c; Gavrilović, 1998). Tokom naših proučavanja na plodićima trešnje sorte stela, uočena je nekroza tkiva i bakterijski eksudat, dok na trešnji sorte germerdorfska nisu zapažene nikakve promene (tab. 7).
Na plodićima kajsije sorte mađarska najbolja, Gavrilović (1998) napominje da najvirulentniji sojevi E. amylovora prouzrokuju pojavu nekroze tkiva i bakterijskog eksudata, što se podudara sa našim rezultatima, dok Mitrev (1995) ističe da se na inokulisanim plodovima kajsije zapaža samo nekroza tkiva, bez pojave kapljica bakterijskog eksudata.
Tokom naših proučavanja na inokulisanim plodićima višnje (ekotip oblačinska), uočena je nekroza i bakterijski eksudat. Arsenijević et al. (1994c) ističu negativnu reakciju na ovom ekotipu višnje i sortama: keleris 14 i keleris 16, dok je sorta hajmanova konzervna reagovala pojavom nekroze tkiva i bakterijskog eksudata.
Nejednaka reakcija nesazrelih plodova nekih vrsta voćaka posle veštačke inokulacije sa E. amylovora, mogla bi se objasniti specifičnošću pojedinih sojeva patogena, ili prevremenim ili kasnijim očitavanjem dobijenih rezultata.
S druge strane, pogodnost plodova nekih voćaka kasnijeg vremena sazrevanja (dunja, mućšmula, divlja kruška, glog, japanska dunja, japanska jabuka, šipak i dr), korišćenih kao test patogenosti u vreme kada su plodovi drugih vrsta već ranije sazreli (šljiva, trešnja, kruška) ukazuje na to da se ovaj test patogenosti može i kasnije primeniti tokom vegetacije, ali i mnogo ranije, ukoliko se koriste nesazreli plodići sa ranijim vremenom sazrevanja (đanarika), u odnosu na najčešće primenjivane plodove (kruška i šljiva) (tab. 7).
Rezultati o ponašanju sojeva E. amylovora dobijeni primenom specifičnih bakterioloških testova, u uslovima priručne laboratorije, podudaraju se sa rezultatima primene ovih testova u registrovanim fitobakteriološkim laboratorijama (tab. 2-6.) (Suslow et al., 1982; Arsenijević i Sremac Smiljana, 1993; Mitrev, 1993,1995; Arsenijević i Jovanović Olivera, 1995; Panić i Arsenijević, 1996). Kod serološkog testa aglutinacije na mikroskopskim pločicama, potvrđena je konstatacija nekih autora (Mitrev, 1993 i dr), da je ovaj test orijentacioni, a ne tačno dijagnostički, jer su pet izolata P. s. pv. syringae (Kš-436, Kš-438, Kš-439, Kš-440 i Kš-441) ispoljili pozitivne rezultate kod serološkog testa aglutinacije. Ovo ukazuje na činjenicu da su termolabilne površinske antigene strukture nespecifične, tako da mogu aglutinirati i sa serumom koji je dobijen od neke druge bakterije, a ne samo od E. amylovora.
Sve napred rečeno, ukazuje na činjenicu da se identifikacija E. amylovora može uspešno izvršiti i u improvizovanim laboratorijama na terenu, bez iskusnog bakteriologa, specijaliste za ovu fitopatološku granu. S obzirom da laboratorije ovakvog tipa nisu registrovane za tu namenu, rezultati do kojih se dolazi u njima mogu korisno poslužiti, bar kao preliminarni, čime se olakšava rad stručnjaka na terenu i sprečavaju moguće greške i propusti, ukoliko se samo okularno prati pojava simptoma obolelih voćaka, bez ijednog testa identifikacije patogena E. amylovora.
LITERATURA
Arsenijević, M. (1975): Bakterioze biljaka. I izdanje, p.236. Poljoprivredni fakultet, Novi Sad.
Arsenijević, M. (1988): Bakterioze biljaka. II izmenjeno i dopunjeno izdanje, p.464. Naučna knjiga, Beograd
Arsenijević, M. (1992): Fitopatogene bakterije, p.166. Naučna knjiga, Beograd.
Arsenijević, M. (1997): Bakterioze biljaka. III izmenjeno i dopunjeno izdanje, p.576. S Print, Novi Sad.
Arsenijević, M., Sremac Smiljana (1993): Pseudomonas syringae pv. syringae, parazit jabuke. Zaštita bilja 206: 283-293, Beograd.
Arsenijević, M., Jovanović Olivera (1995): Novi postupak razlikovanja bakterija po Gramu. Zaštita bilja 211: 57-62, Beograd.
Arsenijević, M., Mitrev, S. (1995): Karakteristike nekih atipičnih sojeva bakterija dobijenih prilikom izolovanja Erwinia amylovora. Zaštita bilja 211: 5-15, Beograd.
Arsenijević, M., Panić, M. (1996): Domaćini bakterije Erwinia amylovora do sada utvrđeni u Jugoslaviji. XI kongres voćara Jugoslavije, Čačak, 28.10. - 01.11.1996. Zbornik rezimea: 145.
Arsenijević, M., Jovanović Gordana (1997): Mogućnost pouzdane i brze identifikacije patogena Erwinia amylovora u uslovima priručne laboratorije. Biljni lekar 4: 439-442, Novi Sad.
Arsenijević, M., Jovanović Gordana (1998): Bakteriozna uvelost i sušenje cvetova i mladara kruške. Biljni lekar 4: 354-357, Novi Sad.
Arsenijević, M., Jovanović Gordana (1999): Još jedan osvrt na mogućnost dokazivanja prisustva bakterije Erwinia amylovora izvan fitobakteriološke laboratorije. Biljni lekar 3: 267-273, Novi Sad.
Arsenijević, M., Panić, M., Antonijević, D. (1991): Fire Blight of Pomaceous Fruit Trees in Yugoslavia. Plant Protection (Zaštita bilja) 196: 87-97, Belgrade.
Arsenijević, M., Sremac Smiljana, Aniko Kočiš (1992): Identifikacione karakteristike bakterije Erwinia amylovora i Pseudomonas syringae pv. syringae izolovanih iz obolelih voćaka. IX jugoslovenski simpozijum o zaštiti bilja. Vrnjačka Banja, 01 - 05.12.1992. Zbornik rezimea: 44 (37).
Arsenijević, M., Đuričić, S., Mitrev, S. (1994a): Serološko identifikovanje izolata bakterije Erwinia amylovora parazita jabučastih voćaka. Zaštita bilja 210: 275-278, Beograd.
Arsenijević, M., Trkulja, V., Jovanović Gordana, Todorović, D. (1994b): Simptomi bakterioznoj plamenjači voćaka nalik i mogućnosti pouzdane i brze identifikacije patogena Erwinia amylovora. III jugoslovenski kongres o zaštiti bilja. Vrnjačka Banja, 03 - 07.10.1994. Zbornik rezimea: 50.
Arsenijević, M., Trkulja, V., Špica Gorica, Keserović, Z. (1994c): Pogodnost nesazrelih plodova raznih vrsta i sorti vo}aka kao testa patogenosti bakterije Erwinia amylovora (Burrill) Winslow et al. III jugoslovenski kongres o zaštiti bilja. Vrnjačka Banja, 03 - 07.10.1994. Zbornik rezimea: 51.
Balaž Jelica, Stamenov, M. (1996): Prilog proučavanju Erwinia amylovora, prouzrokovača bakteriozne plamenjače kruške i jabuke u Vojvodini. Savremena poljoprivreda, Vol.44 (Vanredni broj): 45-49, Novi Sad.
Balaž Jelica, Stamenov, M. (1997): Rasprostranjenost Erwinia amylovora u Vojvodini i preporuke za njeno suzbijanje. XIX seminar iz zaštite bilja. Beograd, 10 - 11.02.1997. Rezimei referata: 33-35.
Balaž Jelica, Ognjanov, V., Stamenov, M., (1997): Erwinia amylovora na jabučastom voću u Vojvodini i mere zaštite. Biljni lekar 1: 55-60, Novi Sad
Billing Eve, Crosse, J. E., Garrett, C. M. E. (1960): Laboratory diagnosis of fire blight and bacterial blossom blight of pear. Plant Pathology 9: 19-25.
Gavrilović, V. (1998): Bakteriološke odlike sojeva Erwinia amylovora (Burrill) Wislow et al., različitog porekla. Magistarska teza, p.68. Poljoprivredni fakultet, Novi Sad. (Zaštita bilja 224: 121 - 167, Beograd).
Jovanović Gordana (1999): Rasprostranjenost, značaj i domaćini bakterije Erwinia amylovora na teritoriji južne Srbije. Magistarska teza, p. 127. Poljoprivredni fakultet, Novi Sad.
Jovanović Gordana, Arsenijević, M. (1998 a): Dosadašnja iskustva stečena na terenu u radu sa Erwinia amylovora. Jugoslovensko voćarstvo (u štampi), Čačak.
Jovanović Gordana, Arsenijević, M. (1998 b): Etiološka proučavanja izumiranja cvetova i mladara kruške. IV jugoslovenski kongres o zaštiti bilja. Vrnjačka Banja, 21 - 26.09.1998. Zbornik rezimea: 65.
Klement, Z., Rudolph, K., Sands, D.C. (1990): Methods in Phytopathology, p.568. Académiai Kiadó, Budapest,Hungary.
Kûdela, V. (1988): Erwinia amylovora - Causal Agent of Fire Blight of Rosaceous Plants in Chechoslovakia. Ochr. Rostl. 24 (3): 173-182.
Kûdela, V. (1990): Spála rú`ovitých rostlin, p.163, Min.zem.a vý` ČSR Výst. zem. a vý`ivy, České Budejovice.
Lelliott, R. A., Stead, D. E. (1987): Methods for the Diagnosis of Bacterial Diseases of Plants, p.216. Britisch Society for Plant Pathology, Blackwell Scientific Publication. Oxford, London and Edinburg.
Mitrev, S. (1993): Proučavanje bakterije Erwinia amylovora (Burrill 1882) Winslow et al. 1920 kao parazita voćaka u Makedoniji. Magistarska teza, p.71. Poljoprivredni fakultet, Novi Sad.
Mitrev, S. (1995): Patogene i bakteriološke karakteristike Erwinia amylovora parazita kruške i dunje u Makedoniji. Zaštita bilja 212: 97-109, Beograd.
Panić, M., Arsenijević, M. (1991): Erwinia amylovora (Burrill) Winslow et al. - Pojava, rasprostranjenost i štetnost u svetu i u Jugoslaviji. Glasnik zaštite bilja 6: 191-197, Zagreb.
Panić, M., Arsenijević, M. (1992): Outbreak, Spread and Economic Importance of Fire Blight Phathogen (Erwinia amylovora) in Yugoslavia. VI International Workshop on Fire Blight, October, 10-12. 1992.,Athens, Greece (Acta Horticulturae 338:89-96,1993).
Panić, M., Arsenijević, M. (1996): Bakteriozna plamenjača voćaka i ukrasnih biljaka - Erwinia amylovora. Monografska studija. Zajednica za voće i povrće, Beograd D. D. i Poljoprivredni fakultet, Novi Sad, p.413.
Panić, M., Arsenijević, M., Antonijević, D. (1994): Rasprostranjenost, domaćini i bakteriološke odlike Erwinia amylovora u Jugoslaviji. III jugoslovenski kongres o zaštiti bilja. Vrnjačka Banja, 03-07.10.1994. Zbornik radova: “Zaštita bilja danas i sutra”, ed. Šestović, M., Nešković, N., Perić, I., pp.145-159, Beograd.
Psallidas, P. G. (1990): Fire blight of Pomaceous trees in Greece. Evaluation of the disease and characteristics of the pathogen Erwinia amylovora. Acta Horticulturae 273: 25-32.
Psallidas, P. G., Dimova Maria (1986): Occurrence of the disease fire blight of Pomaceous trees in Cyprus. Characteristics of the pathogen Erwinia amylovora. Annls Inst. Phytopath. Benaki, Greece, (N. S.) 15: 61-70.
Schaad, N. W. (1980): Laboratory Guide for Identification of Plant Pathogenic Bacteria. American Phytopath. Society, St. Paul, Minnesota.
Suslow, T. W., Schroth, M. N., Isaka, M. (1982): Application of a Rapid method for Gram Differentiation of Plant Pathogenic and Saprophytic Bacteria without Staining. Phytopathology 72: 917-918.
Šutić, D., Panić, M. (1969): Metode proučavanja fitopatogenih bakterija. Zavod za zaštitu bilja Poljoprivrednog fakulteta i Sekretarijat za poljoprivredu, šumarstvo i vodoprivredu Srbije, Beograd.
van der Zwet, T., Keil, H. L. (1979): Fire Blight. A Bacterial Disease of Rosaceous Plants. U.S. Government Printing Office, Washington, D. C. 1-200.
van der Zwet, T., Beer, S. V. (1991): Fire Blight - Its Nature, Prevention and Control. A Practical Guide to Integrated Disease Menagement. U.S. Department of Agriculture. Agricultural Information Bulletin No.631, 83 pp.
Za identifikaciju patogena u uslovima priručne laboratorije, mogu se primeniti opšte poznati testovi i metode, ali i neki modifikovani postupci, iz razloga nepostojanja kompletne laboratorijske opreme i tehnike rada (Arsenijević et al, 1994 b; Jovanović Gordana i Arsenijević, 1998 a,b; Arsenijević i Jovanović Gordana, 1997, 1998, 1999;):
Pri proveri patogenosti, moguće je izvršiti inokulacija lišća duvana i muškatle, inokulacija mladara jabuke, kruške i dunje, cvetova kruške i mladih, tek zametnutih, plodića kruške, kao i inokulacija nesazrelih plodova raznih sorti voćaka i drugih biljnih vrsta (kruške, jabuke, dunje, mušmule, šljive, kajsije, višnje, trešnje, džanarike, divlje kruške, gloga, japanske jabuke, japanske dunje, šipka i limuna),
Osim toga, mogu se inokulisati kriške plodova kruške i jabuke, mahune pasulja, plodovi paprike i kriške krompira (Arsenijević i Sremac Smiljana, 1993; Arsenijević, 1997). Proučeno je i ponašanje bakterija prema Gramu i serološki test aglutinacije na mikroskopskim pločicama
Testovi patogenosti
U uslovima priručne laboratorije postupak identifikacije patogena je skraćen, jer se ne obavlja izolovanje bakterije na hranljivoj podlozi, već se koristi bakterijski eksudat dobijen veštačkom inokulacijom nesazrelih plodića voćaka. Od tako dobijenog bakterijskog eksudata, pripremana je suspenzija bakterija koja je korišćena u daljem radu, kako pri proveri patogenosti, tako i kod bakterioloških testova: ponašanja bakterija prema Gramu i pri serološkom testu aglutinacije na mikroskopskim pločicama.
- Inokulacija lišća duvana i muškatle
Provera patogenosti na listovima duvana i muškatle obavljena je ubrizgavanjem suspenzije bakterija, dobijene korišćenjem bakterijskog eksudata formiranog na nesazrelim plodićima, prethodno inokulisanim česticama obolelog tkiva voćaka. Inokulacija je vršena medicinskim špricem ubrizgavanjem suspenzije bakterija u lisno tkivo (Arsenijević i Jovanović Gordana, 1999).
Inokulisane biljke su održavane u uslovima sobne temperature 24 časa, posle čega je utvrđivana pojava nekrotičnih promena, odnosno pojava hipersenzibilnosti ovih biljaka. Inokulacija lišća duvana i muškatle vodom korišćena je kao negativna kontrola.
- Inokulacija lišća duvana i muškatle
U uslovima priručne laboratorije izvršena je inokulacija lišća duvana i muškatle. Nakon 24 časa od inokulacije, medicinskim špricem, korišćenjem suspenzije bakterija, poreklom od eksudata sa prethodno inokulisanih plodića, (izvršenim pomoću nekrotičnog tkiva obolelih voćaka) dolazi do nekrotičnih promena, odnosno pojave hipersenzibilne reakcije, što ukazuje na moguće prisustvo patogene bakterije E. amylovora ili P. s. pv. syringae. Prilikom inokulacije lišća duvana i muškatle vodom ne uočavaju se nikakve promene.
- Inokulacija mladara jabuke, kruške i dunje
Provera patogenosti je obavljena i inokulacijom mladara jabuke sorte ajdared, kruške sorte butira i dunje sorte leskovačka. Inokulacija je vršena nanošenjem suspenzije bakterija, dobijene korišćenjem bakterijskog eksudata (poreklom sa plodića prethodno inokulisanog nekrotičnim tkivom), ubodom mladara pomoću igle na nekoliko mesta u čvrsto tkivo mladara ili njegov zeljasti deo.
Posle inokulacije, mladari su isprskani vodom i postavljani u vlažnu komoru 2-3 dana, a zatim su održavani u uslovima sobne temperature. Rezultati su očitavani posle 3, 5, 7, 10 i 15 dana od inokulacije. Kontrolni mladari jabuke, kruške i dunje su tretirani istim postupkom, ali umesto suspenzije korišćena je voda.
-Inokulacija mladara jabuke, kruške i dunje
Na mladarima jabuke sorte ajdared, kruške sorte butira i dunje sorte leskovačka, inokulisanih ubodom i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, dolazi do pojave nekroze oko mesta uboda posle 3-4 dana od inokulacije. Narednih nekoliko dana nastaje nekroza vrha mladara, koji se često kukasto povija. Za oko 12 dana ceo mladar vene i izumire. Na kontrolnim mladarima inokulisanim vodom ne uočavaju se nikakve promene.
- Inokulacija cvetova kruške i mladih tek zametnutih plodića kruške
Inokulacija cvetova kruške sorte santa marija, obavljena je nanošenjem kapi suspenzije bakterija (dobijene korišćenjem bakterijskog eksudata poreklom sa plodića inokulisanih nekrotičnim tkivom), na žig tučka i prašnike, a inokulacija tek zametnutih plodića kruške sorte santa marija nanošenjem suspenzije bakterija ubodom igle u tkivo mladih, tek, zametnutih plodića.
Nakon inokulacije, mladari sa inokulisanim cvetovima, i tek formiranim plodićima, postavljani su u vlažnu komoru 2-3 dana, a zatim prenošeni u uslove sobne temperature. Rezultati su očitavani posle 3, 5, 7, 10 i 15 dana. Inokulacija cvetova kruške i mladih tek zametnutih plodića kruške vodom korišćena je kao negativna kontrola.
- Inokulacija cvetova kruške i mladih tek zametnutih plodića kruške
Na cvetovima kruške sorte santa marija, 2-3 dana posle inokulacije prskanjem i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, primećuju se prve nekrotične promene na čašici cveta gde je izvršena inokulacija. Narednih dana nekroza se širi, tako da se posle 5-7 dana od inokulacije uočava nekroza cvetova i cvetne drške, koji pocrne i izumiru.
Nakon inokulacije mladih, tek zametnutih plodića kruške sorte santa marija ubodom u tkivo ploda, najpre se primećuje nekrotična zona oko mesta inokulacije na plodiu, a nakon 7 dana nastaje nekroza i izumiranje ploda i drške plodića. Infekcija se dalje širi, tako da patogen parazitira lišće i mladar, koji nekrotiraju i suše se zajedno sa plodićima. Na kontrolnim cvetovima i mladim, tek zametnutim plodićima kruške, inokulisanim vodom, ne uočavaju se nikakve promene.
- Inokulacija nesazrelih plodova raznih sorti voćaka i drugih biljnih vrsta
Za veštačku inokulaciju nesazrelih plodova korišćeno je vi{še raznih vrsta i sorti biljaka, kako bi se utvrdilo koja od njih najbrže reaguje pojavom nekroze i stvaranjem bakterijskog eksudata (tab. 7). Testirani su plodići sledećih vrsta i sorti biljaka: kruška (Pyrus domestica Medicus.) - sorte: viljamova, kaluđerka, pasakrasan i santa marija; jabuka (Malus domestica Borkh.) - sorte: ajdared i spergold; dunja (Cydonia oblonga Mill.) - sorta: leskovačka; mušmula (Mespilus germanica L.) - domaća mušmula; šljiva (Prunus domestica L.) - sorta: stenli; kajsija (Prunus armeniaca L.) - sorta: mađarska najbolja; višnja (Prunus cerasus L.) - ekotip: oblačinska (izdvojen iz spontane populacije); trešnja (Prunus avium L.) - sorte: stela i germerdorfska; đanarika (Prunus cerasifera Ehrh.); divlja kruška (Pyrus piraster Burgs.); glog (Crataegus monogyna Jacq.); japanska jabuka (Diospyros kaki L.); japanska dunja (Chaenomeles japonica (Thunb.) Lindl.); šipak (Rosa canina L.); i limun (Citrus limonum Risso.).
Inokulacija mladih, nesazrelih plodića je obavljena nanošenjem kapi suspenzije bakterija, ubodom igle na po tri mesta u tkivo plodića (u vidu trougla). Potrebna suspenzija bakterija je dobijena korišćenjem bakterijskog eksudata formiranog na nesazrelim plodićima šljive (prethodno inokulisanim), unošenjem nekrotičnih čestica (uzetih sa tkiva obolelih voćaka) u tkivo plodova, ili upotrebom macerata. Inokulisani plodići su održavani u vlažnoj komori 1-2 dana, a potom postavljani na laboratorijske stolove, pri uslovima sobne temperature. Rezultati su očitavani posle 2 do 12 dana od inokulacije (Arsenijević et al., 1994 c; Arsenijević i Jovanović Gordana, 1997, 1999). Kontrolni, nesazreli plodići tretirani su vodom.
Inokulacija nesazrelih plodova raznih voćaka i drugih vrsta biljaka u priručnoj laboratoriji
Provera patogenosti je obavljena inokulacijom raznih sorti nesazrelih plodova kruške, jabuke, dunje, mušmule, šljive, kajsije, višnje, trešnje, zatim djanarike, divlje kruške, gloga, japanske jabuke, japanske dunje, šipka i limuna, ubodom igle (tab. 1). Korišćena je suspenzija bakterija poreklom od eksudata sa prethodno inokulisanih plodića upotrebom macerata, dobijenog gnječenjem nekrotičnog tkiva. U tab. 7 prikazano je vreme pojave nekrotičnih promena i formiranja kapi bakterijskog eksudata na inokulisanim plodićima raznih biljnih vrsta korišćenih u našim istraživanjima.
Tab.1. Vreme pojave nekrotičnih promena i formiranja kapljica bakterijskog eksudata na inokulisanim plodićima raznih vrsta biljaka
|
Vrsta Species |
Sorta Cultivar |
Nekrotične promene (posle dana) Tissue necrosis (after days) |
Bakterijski eksudat (posle dana) Bacterial exudate (after days) |
Patogen Pathogen |
|
Kruška Pear |
Pasakrasana Passa crassana Viljamova William*s pear Kalu|erka “Kaludjerka” Santa Marija Santa Maria |
2-3 |
3-4 |
|
|
Jabuka Apple |
Ajdared Idared Spergold Goldspur |
4-5 |
7-10 |
|
|
Dunja Quince |
Leskovačka Leskovac variety Vranjska Vranje variety |
7 |
10-12 |
|
|
Mušmula Medlar |
Domaća Domestic variety |
7-10 | 12-13 | |
|
Šljiva Plum |
Stenli Stanley |
1-2 | 2-3 | Erwinia |
|
Kajsija Apricot |
Ma|arska najbolja Hungarian the best |
2-3 |
7-10 |
amylovora |
|
Višnja Sour-cherry |
Oblačinska Oblačinska variety |
5-6 | 13 | |
|
Trešnja Cherry |
Stela Stella Germerdorfska Germerdorf |
4-5 - |
7 - |
|
|
Đanarika “D`anarika” - Plum |
2-3 |
4 |
||
|
Divlja kruška Wild pear |
2 | 2-3 | ||
|
Glog Hawthorn |
2-3 | 3-4 | ||
|
Japanska jabuka Japanese apple |
2-3 |
4-5 |
||
|
Japanska dunja Japanese quince |
5-7 |
9-10 |
||
|
Šipak Hip |
7-8 | 12-13 | ||
|
Limun Lemon |
1-2 | - |
P.syringae pv. syringae |
- Inokulacija kriški plodova kruške i jabuke
Inokulacija preseka plodova kruške sorte pasakrasan i jabuke sorte spergold, obavljena je prelivanjem suspenzije bakterija, dobijene korišćenjem bakterijskog eksudata formiranog na prethodno inokulisanim plodićima voćaka, preko preseka plodića, medicinskim špricem (Arsenijević i Jovanović Gordana, 1999).
Nakon inokulacije, delovi plodića su postavljani u Petri kutije sa navlaženim filter papirom, a ove u vlažnu komoru 1-2 dana. Potom su iznete na laboratorijske stolove, pri uslovima sobne temperature. Rezultati su očitavani posle 3, 5 i 7 dana od inokulacije (Billing et al., 1960; Panić i Arsenijević, 1996). Kontrolne kriške plodova kruške i jabuke tretirane su vodom.
- Inokulacija nesazrelih plodova kruške
Prilikom veštačke inokulacije nesazrelih plodova kruške sorti: viljamova, kaluđerka, santa marija i pasakrasan, 2-3 dana nakon inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, primećuju se nekrotične pege oko mesta uboda, a posle 3-4 dana pojavljuju se kapljice bakterijskog eksudata beličaste boje. Narednih dana stvaranje eksudata je obilnije, a njegova boja je tamnija. Za oko nedelju dana plod potpuno nekrotira i pocrni (tab. 7). Pri inokulaciji raznih sorti plodova kruške, nema razlike u pogledu vremena formiranja kapi bakterijskog eksudata (tab. 7). Na kontrolnim plodićima koji su inokulisani vodom ne uočava se nikakva promena na pokožici ploda.
-Inokulacija nesazrelih plodova jabuke
Na nesazrelim plodovima jabuke sorti: ajdared i spergold, nakon 4-5 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, pojavljuje se nekroza pokožice ploda, a posle 7-10 dana uočava se pojava bakterijskog eksudata u vidu izuzetno finih i sitnih kapi beličaste boje (tab. 7). Kod jabuke sorti: ajdared i spergold nema razlike u pogledu vremena formiranja kapi bakterijskog eksudata. Na kontrolnim plodićima jabuke inokulisanim vodom ne uočavaju se nikakve promene.
-Inokulacija nesazrelih plodova dunje
Na nesazrelim plodovima dunje sorti: vranjska i leskovačka, tek nakon 7 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, uočavaju se nekrotične promene na pokožici plodića, a nakon 10-12 dana formiraju se sitne, fine kapi bakterijskog eksudata beličaste boje (tab. 7.). Kod plodova dunje sorti: vranjska i leskovačka, nema razlike u vremenu formiranja kapi bakterijskog eksudata. Na kontrolnim plodićima inokulisanim vodom ne uočavaju se nikakve promene.
-Inokulacija nesazrelih plodova mušmule
Na inokulisanim nesazrelim plodićima domaće mušmule prve nekrotične promene oko mesta uboda, izvrššenog ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, primećuju se 7-10 dana od inokulacije. Nakon 12-13 dana pojavljuje se bakterijski eksudat boje meda, ispoljen u vidu finih, sitnih kapi oko mesta inokulacije (tab. 7). Na kontrolnim plodićima inokulisanim vodom ne uočavaju se nikakve promene.
- Inokulacija nesazrelih plodova šljive
Na inokulisanim plodićima šljive sorte stenli, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, prve promene ispoljene u vidu nekrotičnih zona oko mesta uboda pojavljuju se već posle 24-48 sati. Istovremeno, ili nešto kasnije, uočavaju se sitne beličaste kapi bakterijskog eksudata formirane oko mesta gde je izvršena inokulacija ili nešto dalje po površini plodića. Narednih dana formiranje eksudata je izraženije. Tokom sedam dana plodić potpuno nekrotira i pocrni (tab.7.). Na kontrolnim plodićima šljive inokulisanim vodom ne zapažaju se nikakve promene.
- Inokulacija nesazrelih plodova kajsije
Na nesazrelim plodovima kajsije sorte mađarska najbolja, nakon 2-3 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, uočavaju se nekrotične promene preko cele površine plodića, a nakon 7-10 dana od inokulacije dolazi do formiranja kapljica bakterijskog eksudata, beličastokrem boje, po celoj površini plodića (tab. 7.). Na kontrolnim plodićima inokulisanim vodom ne uočavaju se nikakve promene.
- Inokulacija nesazrelih plodova višnje
Na inokulisanim plodovima višnje, ekotip oblačinska, nakon 5-6 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, pojavljuju se nekrotične promene oko mesta uboda. Narednih dana nekrotični proces se širi, da bi nakon 10-12 dana cela površina plodića nekrotirala i dobila tamnomrku boju. Tek posle 13 dana primećuju se jako sitne beličaste kapi bakterijskog eksudata oko mesta inokulacije (tab. 7). Na kontrolnim plodićima inokulisanim vodom ne uočavaju se nikakve promene.
- Inokulacija nesazrelih plodova trešnje
Obavljena je inokulacija sorti: stela i germerdorfska, pri čemu je reakcija plodića različita. Na plodovima trešnje sorte stela nakon 4-5 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića maceratom, pojavljuju se nekrotične promene oko mesta uboda, a posle 7 dana primećuju se beličaste kapi bakterijskog eksudata u delu gde nekrotira pokožica ploda. Nakon toga, dolazi do potpunog nekrotiranja plodića, koji dobija tamnomrku boju, a istovremeno se uočava i obilno formiranje eksudata beličaste boje. Eksudat se najpre nalazi oko mesta inokulacije, a potom se spaja i sliva u vidu krupne beličaste kapi (tab. 7). Istovremeno, primećuje se destrukcija ploda, koji dobija neravnu, grubu površinu. Na plodićima trešnje sorte germerdorfska i na kontrolnim plodićima koji su inokulisani vodom, nije primećena nikakva promena na pokožici plodića.
- Inokulacija nesazrelih plodova đanarike
Na nesazrelim plodovima đanarike, nakon 2-3 dana od inokulacije, ubodom igle i korišenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića maceratom primećuje se nekrotična promena pokožice plodića, a posle 4 dana dolazi do pojave sitnih i finih kapi bakterijskog eksudata beličaste boje, u predelu gde pokožica ploda nekrotira (tab. 7). Na kontrolnim plodićima inokulisanim vodom ne zapažaju se nikakve promene.
- Inokulacija nesazrelih plodova divlje kruške
Prilikom veštačke inokulacije nesazrelih plodova divlje kruške, ubodom igle i korišćenjem suspenzije bakterija, poreklom od eksudata sa prethodno inokulisanih plodića maceratom prve promene u vidu nekroze oko mesta uboda, primećuju se nakon 2 dana od inokulacije, a posle 3 dana zapaža se pojava beličastih kapi bakterijskog eksudata oko mesta inokulacije (tab. 7). Na inokulisanim kontrolnim plodićima divlje kruške ne uočavaju se nikakve promene.
- Inokulacija nesazrelih plodova gloga
Na nesazrelim plodovima gloga, nakon 2-3 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija, poreklom od eksudata sa prethodno inokulisanih plodića maceratom, uočava se razvoj nekrotičnih promena oko mesta uboda. Istovremeno, ili nešto kasnije, dolazi do formiranja kapljica bakterijskog eksudata. Nekroza se postepeno širi, tako da za 7 dana plod potpuno nekrotira i pocrni (tab. 7). Na kontrolnim plodićima inokulisanim vodom ne uočavaju se nikakve promene.
- Inokulacija nesazrelih plodova japanske jabuke
Na nesazrelim plodovima japanske jabuke, nakon 2-3 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija, poreklom od eksudata sa prethodno inokulisanih plodića, primećuje se nekroza pokožice ploda, kao i nekroza peteljke i čašice plodića. Sledećeg dana oni se odvajaju od plodića i otpadaju, a sa unutrašnje strane čašičnih listića koji su potpuno nekrotirali, pojavljuju se krupne žućkaste kapi bakterijskog eksudata. Istovremeno i površina plodića potpuno nekrotira, dobija tamnomrku boju, a nakon 4-5 dana primećuju se beličastožućkaste kapi bakterijskog eksudata (tab. 7). Na kontrolnim plodićima inokulisanim vodom ne uočavaju se nikakve promene.
- Inokulacija nesazrelih plodova japanske dunje
Na nesazrelim plodovima japanske dunje, nakon 5-7 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, uočavaju se nekrotične promene po površini plodića. Pojava kapljica bakterijskog eksudata beličaste do svetlonaranđaste boje, uočava se 9-10 dana od inokulacije (tab. 7).
Isto tako, na plodićima japanske dunje nekada se uočava pojava beličastih, vrlo sitnih kapi bakterijskog eksudata po površini plodića (nakon 9 dana od inokulacije), a već sledećeg dana primećuje se nekroza pokožice ploda u predelu gde se nalazi eksudat. Na kontrolnim plodićima inokulisanim vodom ne zapažaju se nikakve promene.
- Inokulacija nesazrelih plodova šipka
Na nesazrelim plodovima šipka tek nakon 7-8 dana od inokulacije, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića, dolazi do nekrotičnih promena oko mesta uboda, a posle 12-13 dana pojavljuju se kapi bakterijskog eksudata boje meda (tab. 7). Na kontrolnim plodićima inokulisanih vodom ne uočavaju se nikakve promene.
- Inokulacija plodova limuna
Prilikom inokulacije nesazrelih plodova limuna, ubodom igle i korišćenjem suspenzije bakterija poreklom od eksudata, ne uočavaju se nikakve promene na plodićima. Suprotno tome, bakterija P. syringae pv. syringae prouzrokuje pojavu nekrotičnih zona oko mesta uboda. Plodovi limuna, inače se preporučuju za identifikaciju ovog patogena (Psallidas i Dimova, 1986; Arsenijević, 1992; Arsenijević i Sremac Smiljana, 1993). Na kontrolnim plodovima limuna inokulisanih vodom, nisu uočene nikakve promene.
- Inokulacija kriški plodova kruške i jabuke
Inokulacijom kriški plodova kruške sorti: pasakrasan i kaluđerka, prelivanjem suspenzije bakterija poreklom od eksudata sa prethodno inokulisanih plodića maceratom do pojave kapi bakterijskog eksudata dolazi posle 3 dana. Narednih dana stvaranje eksudata je obilnije, tako da posle 6 dana bakterijski eksudat preliva celu površinu preseka kruške.
Na inokulisanim kriškama jabuke sorte spergold, dolazi do nekrotičkih procesa, odnosno pojave svetlo do tamnomrke boje mezokarpa plodića. Nakon 7 dana od inokulacije primećuju se na preseku ploda jabuke pojedinačne kapi bakterijskog eksudata i blagi preliv, jedva vidljiv na mezokarpu plodića. Na kontrolnim kriškama plodova kruške i jabuke inokulisanim vodom, ne uočavaju se nikakve promene.
- Inokulacija mahuna pasulja, plodova paprike i krtola krompira
Nesazrele mahune pasulja i plodovi paprike su inokulisani medicinskim špricem ubrizgavanjem suspenzije bakterija, dobijene korišćenjem bakterijskog eksudata formiranog na prethodno inokulisanim plodićima voćaka.
Inokulisane mahune pasulja i plodovi paprike su postavljani u vlažne komore, a 48 sati posle inokulacije izloženi uslovima sobne temperature (Arsenijević, 1988, 1992; Arsenijević et al., 1992; Arsenijević i Sremac Smiljana, 1993).
Inokulacija kriški krompira je obavljena premazom suspenzije bakterija preko preseka kriške. Ovako inokulisane kriške postavljane su u Petri kutije sa navlaženim filter papirom, a očitavanje rezultata je vršeno 3, 5 i 7 dana posle inokulacije. Tretiranje mahuna pasulja, plodova paprike i kriški krompira vodom je korišćeno kao kontrola.
- Inokulacija mahuna pasulja, plodova paprike i kriški krompira
Na mahunama pasulja inokulisanim suspenzijom bakterija poreklom od eksudata sa prethodno inokulisanih plodića, dolazi do pojave svetlomrkih pega, koje ne uležu u tkivo, što ukazuje na prisustvo E. amylovora, dok se prisustvo P. syringae pv. syringae ispoljava formiranjem ulegnutih, nekrotičnih pega na inokulisanim mahunama.
Na plodovima paprike, nakon inokulacije sa E. amylovora ne dolazi ni do kakvih promena, što ukazuje na odsustvo ove bakterije u maceriranom tkivu, dok u slučaju prisustva P. syringae pv. syringae na inokulisanim plodovima paprike nastaje nekroza tkiva oko mesta uboda, koja se vremenom širi i povećava. Na inokulisanim kriškama krompira nisu utvrđene nikakve promene. Kod kontrolnih mahuna pasulja, plodova paprike i kriški krompira inokulisanih vodom, ne uočavaju se nikakve promene.
Primena specifičnih testova identifikacije patogena u priručnoj laboratoriji
- Ponašanje bakterija prema Gramu
Ponašanje bakterija prema Gramu, u uslovima priručne laboratorije, proučeno je primenom 3% KOH, tako što se na mikroskopsku pločicu nanosi kap 3% KOH a zatim pomoću čačkalice za zube uzme jedan zahvat bakterijskog eksudata formiranog na plodiću inokulisanog suspenzijom bakterija ili fragmentom nekrotičnog tkiva. Zatim se obe kapi čačkalicom dobro homogenizuju. Podizanjem čačkalice 1-2 cm uvis iznad mikroskopske pločice, uz pojavu niti ili „končića“ dokazuje se prisustvo gramnegativnih bakterija (Arsenijević i Jovanović Olivera, 1995 i Arsenijević i Jovanović Gordana, 1997, 1999).
- Ponašanje bakterija prema Gramu
Pokazalo se da se ovaj test može izvesti, kako u opremljenim bakteriološkim laboratorijama, tako i u uslovima priručne laboratorije. Prilikom homogenizacije kapi 3% KOH i kapi bakterijskog eksudata poreklom sa prethodno inokulisanih plodića voćaka maceratom nekrotičnog tkiva dolazi do formiranja “končića”, odnosno fine vidljive niti, koja predstavlja znak gramnegativnog ponašanja bakterija uopšte uzev, a u našem slučaju bakterije E. amylovora.
- Serološki test aglutinacije na mikroskopskim pločicama
Serološki test aglutinacije na mikroskopskim pločicama je izveden korišćenjem antiseruma E. amylovora proizvedenog u našoj zemlji pomoću autentičnog soja bakterije E. amylovora 1430 (poreklom iz Francuske), koji je postojao u kolekciji bakterija prof. M. Arsenijevića na Poljoprivrednom fakultetu u Novom Sadu. Antiserum bakterije E. amylovora, laboratorija Zavoda u Leskovcu je dobila posredstvom prof. M. Arsenijevića.
Test je primenjen uobičajenim postupkom, s tom razlikom što se ovde, umesto kulture E. amylovora koristi bakterijski eksudat sa plodića prethodno inokulisanog obolelim tkivom i nanosi na mikroskopsku pločicu (Arsenijević i Jovanović Gordana, 1997, 1999).
Kap nanetog antiseruma i bakterijski eksudat se na pločici dobro homogenizuju mešanjem pomoću čačkalice za zube. Pojava sitnih, peskovitih čestica u vidu pahuljastog taloga znak je aglutinacije.
- Serološki test aglutinacije na mikroskopskim pločicama
U uslovima priručne laboratorije uspešno je izveden i test aglutinacije na mikroskopskim pločicama, gde nakon mešanja kapi antiseruma i kapi bakterijskog eksudata poreklom sa prethodno inokulisanih plodića voćaka maceratom nekrotičnog tkiva dolazi do stvaranja pahuljastog taloga, što predstavlja znak prisustva bakterije E. amylovora.
DISKUSIJA
Vizuelna dijagnoza bakteriozne plamenjače vošaka, koju prouzrokuje E. amylovora, ne mora uvek biti pouzdana i tačna. Jer, simptome nalik ovoj bolesti, koji se uočavaju na terenu, mogu prouzrokovati i neki drugi agensi biotske i abiotske prirode (van der Zwet i Keil, 1979; Kudela, 1990; van der Zwet i Beer, 1991; Panić i Arsenijević 1996; Jovanović Gordana, 1999). Zbog toga je identifikacija patogena u fitobakteriološkim laboratorijama namenjenim za tu svrhu, i najpouzdanija.
Istovremeno sa proučavanjem ponašanja izolata bakterije u fitopatološkim laboratorijama, vršena su i uporedna proučavanja patogena u priručnoj laboratoriji. Zato je od uzoraka obolelih biljaka prikupljenih sa terena, jedan deo dostavljan Fakultetu i Institutu, a drugi deo je ostavljan radi proučavanja u priručnoj laboratoriji Zavoda.
Ispostavilo se, međutim, da osim u bakteriološkim laboratorijama fakulteta i instituta, uspešna identifikacija E. amylovora se može obaviti i u uslovima priručne laboratorije na terenu, primenom ustaljenih i nekih modifikovanih postupaka (tab. 1) (Arsenijević i Jovanović Gordana, 1997,1999; Jovanović Gordana 1999), primenjenih tokom ovih istraživanja u Zavodu za poljoprivredu „Leskovac” u Leskovcu, jer su dobijeni rezultati o ponašanju bakterije, korišćenjem osnovnih testova identifikacije gotovo identični.
U fitobakteriološkim laboratorijama fakulteta i instituta izvršeno je izolovanje bakterije na mesopeptonskoj (MPP) i mesopeptonskoj podlozi obogaćenoj s 5% saharoze (NAS) (sl. 1). Pri tome je izolovano 154 soja bakterija, od čega je 104 imalo odlike bakterije E. amylovora, a 18 sojeva odlike P.s.pv.syringae. (tab. 2-6). Takođe su izolovani sojevi koji verovatno ukazuju na karakteristike saprofitske bakterije E. herbicola i predstavnici Pseudomonas sp. (Billing et al., 1960; Psallidas i Dimova, 1986; Lelliott i Stead, 1987; Mitrev, 1993, 1995; Arsenijević i Mitrev, 1995; Panić i Arsenijević, 1996; Gavrilović, 1998).
Morfološke, odgajivačke i patogene odlike izlovanih sojeva E. amylovora poreklom s obolelih stabala kruške, jabuke, dunje, mušmule, divlje kruške, gloga, sadnica jabuke i matičnih stabala kruške u potpunosti se podudaraju sa podacima iz literature (Billing et al., 1960; van der Zwet i Keil, 1979; Psallidas i Dimova, 1986; Lelliott i Stead, 1987; Panić et al., 1994 i dr).
U uslovima priručne laboratorije Zavoda za poljoprivredu „Leskovac” u Leskovcu, uspešno su primenjeni testovi patogenosti i to: inokulacija lišća duvana i muškatle, inokulacija mladara jabuke, kruške i dunje, cvetova kruške i mladih, tek formiranih plodića kruške, inokulacija nesazrelih plodića raznih sorti voćaka i drugih biljnih vrsta, reakcija po Gramu, serološki test aglutinacije na mikroskopskim pločicama, kao i inokulacija mahuna pasulja, plodova paprike i kriški krompira. Ove testove u cilju provere patogenosti i identifikacije E. amylovora ističu mnogi autori (Billing et al., 1960; van der Zwet i Keil, 1979; Psallidas i Dimova, 1986; Arsenijević, 1992, 1997; Arsenijević et al., 1994c; Panić i Arsenijević 1996).
Za sve ove testove upotrebljena je suspenzija bakterija, pripremljena korišćenjem bakterijskog eksudata proizvedenog veštačkom inokulacijom nesazrelih plodića voćaka, česticama nekrotičnog tkiva prirodno inficiranog, jer se ne vrši izolovanje bakterije na hranljivoj podlozi (Arsenijević i Jovanović Gordana, 1997, 1999).
U tome je i osnovna razlika u proučavanju ponašanja bakterije primenom osnovnih testova identifikacije, jer je u fitobakteriološkim laboratorijama umesto bakterijskog eksudata, korišćena suspenzija bakterija pripremljena od kultura, razvijenih na hranljivoj podlozi.
Prilikom provere patogenosti sojevi E. amylovora i P. syringae pv syringae ispoljavaju isti tip promena na inokulisanim listovima duvana i muškatle, mladarima jabuke, kruške i dunje, cvetovima kruške i mladim, tek zametnutim plodićima kruške. Zbog toga je inokulacija nesazrelih plodića voćaka poslužila kao osnovni diferencijalni test, jer pojava nekrotičnih zona sa kapima bakterijskog eksudata nedvosmisleno ukazuje na prisustvo E. amylovora. Zato je u uslovima priručne laboratorije ovaj test detaljnije proučen, kada je obavljena inokulacija više raznih vrsta i sorti voćaka sa različitim vremenom sazrevanja tokom vegetacije.
Inokulaciju nesazrelih plodića voćaka (šljive, kruške, kajsije, jabuke, trešnje i dr.), kao pouzdani i brzi test provere patogenosti ističu mnogi autori (Billing et al., 1960; Psallidas i Dimova, 1986; Mitrev, 1993; Arsenijević et al., 1994c; Panić i Arsenijević, 1996). Naši autori izvesnu prednost daju plodićima šljive sorte stenli (Mitrev, 1993; Arsenijević et al., 1994c; Panić i Arsenijević, 1996). Ali su i plodići kruške (Billing et al., 1960; Psallidas i Dimova, 1986; Arsenijević et al., 1994c) vrlo pogodni za proveru patogenosti E. amylovora, što se podudara s našim rezultatima (tab. 7). Billing et al. (1960) napominju da su kriške kruške izuzetno pogodne za proveru patogenosti, što potvrđuju i naši rezultati, jer je test vrlo jednostavan, efikasan i brz.
Prema nekim rezultatima dobijenim u našoj zemlji, plodići trešnje sorte Sue pogodniji su za inokulaciju od plodića kruške (Arsenijević et al., 1994c; Gavrilović, 1998). Tokom naših proučavanja na plodićima trešnje sorte stela, uočena je nekroza tkiva i bakterijski eksudat, dok na trešnji sorte germerdorfska nisu zapažene nikakve promene (tab. 7).
Na plodićima kajsije sorte mađarska najbolja, Gavrilović (1998) napominje da najvirulentniji sojevi E. amylovora prouzrokuju pojavu nekroze tkiva i bakterijskog eksudata, što se podudara sa našim rezultatima, dok Mitrev (1995) ističe da se na inokulisanim plodovima kajsije zapaža samo nekroza tkiva, bez pojave kapljica bakterijskog eksudata.
Tokom naših proučavanja na inokulisanim plodićima višnje (ekotip oblačinska), uočena je nekroza i bakterijski eksudat. Arsenijević et al. (1994c) ističu negativnu reakciju na ovom ekotipu višnje i sortama: keleris 14 i keleris 16, dok je sorta hajmanova konzervna reagovala pojavom nekroze tkiva i bakterijskog eksudata.
Nejednaka reakcija nesazrelih plodova nekih vrsta voćaka posle veštačke inokulacije sa E. amylovora, mogla bi se objasniti specifičnošću pojedinih sojeva patogena, ili prevremenim ili kasnijim očitavanjem dobijenih rezultata.
S druge strane, pogodnost plodova nekih voćaka kasnijeg vremena sazrevanja (dunja, mućšmula, divlja kruška, glog, japanska dunja, japanska jabuka, šipak i dr), korišćenih kao test patogenosti u vreme kada su plodovi drugih vrsta već ranije sazreli (šljiva, trešnja, kruška) ukazuje na to da se ovaj test patogenosti može i kasnije primeniti tokom vegetacije, ali i mnogo ranije, ukoliko se koriste nesazreli plodići sa ranijim vremenom sazrevanja (đanarika), u odnosu na najčešće primenjivane plodove (kruška i šljiva) (tab. 7).
Rezultati o ponašanju sojeva E. amylovora dobijeni primenom specifičnih bakterioloških testova, u uslovima priručne laboratorije, podudaraju se sa rezultatima primene ovih testova u registrovanim fitobakteriološkim laboratorijama (tab. 2-6.) (Suslow et al., 1982; Arsenijević i Sremac Smiljana, 1993; Mitrev, 1993,1995; Arsenijević i Jovanović Olivera, 1995; Panić i Arsenijević, 1996). Kod serološkog testa aglutinacije na mikroskopskim pločicama, potvrđena je konstatacija nekih autora (Mitrev, 1993 i dr), da je ovaj test orijentacioni, a ne tačno dijagnostički, jer su pet izolata P. s. pv. syringae (Kš-436, Kš-438, Kš-439, Kš-440 i Kš-441) ispoljili pozitivne rezultate kod serološkog testa aglutinacije. Ovo ukazuje na činjenicu da su termolabilne površinske antigene strukture nespecifične, tako da mogu aglutinirati i sa serumom koji je dobijen od neke druge bakterije, a ne samo od E. amylovora.
Sve napred rečeno, ukazuje na činjenicu da se identifikacija E. amylovora može uspešno izvršiti i u improvizovanim laboratorijama na terenu, bez iskusnog bakteriologa, specijaliste za ovu fitopatološku granu. S obzirom da laboratorije ovakvog tipa nisu registrovane za tu namenu, rezultati do kojih se dolazi u njima mogu korisno poslužiti, bar kao preliminarni, čime se olakšava rad stručnjaka na terenu i sprečavaju moguće greške i propusti, ukoliko se samo okularno prati pojava simptoma obolelih voćaka, bez ijednog testa identifikacije patogena E. amylovora.
LITERATURA
Arsenijević, M. (1975): Bakterioze biljaka. I izdanje, p.236. Poljoprivredni fakultet, Novi Sad.
Arsenijević, M. (1988): Bakterioze biljaka. II izmenjeno i dopunjeno izdanje, p.464. Naučna knjiga, Beograd
Arsenijević, M. (1992): Fitopatogene bakterije, p.166. Naučna knjiga, Beograd.
Arsenijević, M. (1997): Bakterioze biljaka. III izmenjeno i dopunjeno izdanje, p.576. S Print, Novi Sad.
Arsenijević, M., Sremac Smiljana (1993): Pseudomonas syringae pv. syringae, parazit jabuke. Zaštita bilja 206: 283-293, Beograd.
Arsenijević, M., Jovanović Olivera (1995): Novi postupak razlikovanja bakterija po Gramu. Zaštita bilja 211: 57-62, Beograd.
Arsenijević, M., Mitrev, S. (1995): Karakteristike nekih atipičnih sojeva bakterija dobijenih prilikom izolovanja Erwinia amylovora. Zaštita bilja 211: 5-15, Beograd.
Arsenijević, M., Panić, M. (1996): Domaćini bakterije Erwinia amylovora do sada utvrđeni u Jugoslaviji. XI kongres voćara Jugoslavije, Čačak, 28.10. - 01.11.1996. Zbornik rezimea: 145.
Arsenijević, M., Jovanović Gordana (1997): Mogućnost pouzdane i brze identifikacije patogena Erwinia amylovora u uslovima priručne laboratorije. Biljni lekar 4: 439-442, Novi Sad.
Arsenijević, M., Jovanović Gordana (1998): Bakteriozna uvelost i sušenje cvetova i mladara kruške. Biljni lekar 4: 354-357, Novi Sad.
Arsenijević, M., Jovanović Gordana (1999): Još jedan osvrt na mogućnost dokazivanja prisustva bakterije Erwinia amylovora izvan fitobakteriološke laboratorije. Biljni lekar 3: 267-273, Novi Sad.
Arsenijević, M., Panić, M., Antonijević, D. (1991): Fire Blight of Pomaceous Fruit Trees in Yugoslavia. Plant Protection (Zaštita bilja) 196: 87-97, Belgrade.
Arsenijević, M., Sremac Smiljana, Aniko Kočiš (1992): Identifikacione karakteristike bakterije Erwinia amylovora i Pseudomonas syringae pv. syringae izolovanih iz obolelih voćaka. IX jugoslovenski simpozijum o zaštiti bilja. Vrnjačka Banja, 01 - 05.12.1992. Zbornik rezimea: 44 (37).
Arsenijević, M., Đuričić, S., Mitrev, S. (1994a): Serološko identifikovanje izolata bakterije Erwinia amylovora parazita jabučastih voćaka. Zaštita bilja 210: 275-278, Beograd.
Arsenijević, M., Trkulja, V., Jovanović Gordana, Todorović, D. (1994b): Simptomi bakterioznoj plamenjači voćaka nalik i mogućnosti pouzdane i brze identifikacije patogena Erwinia amylovora. III jugoslovenski kongres o zaštiti bilja. Vrnjačka Banja, 03 - 07.10.1994. Zbornik rezimea: 50.
Arsenijević, M., Trkulja, V., Špica Gorica, Keserović, Z. (1994c): Pogodnost nesazrelih plodova raznih vrsta i sorti vo}aka kao testa patogenosti bakterije Erwinia amylovora (Burrill) Winslow et al. III jugoslovenski kongres o zaštiti bilja. Vrnjačka Banja, 03 - 07.10.1994. Zbornik rezimea: 51.
Balaž Jelica, Stamenov, M. (1996): Prilog proučavanju Erwinia amylovora, prouzrokovača bakteriozne plamenjače kruške i jabuke u Vojvodini. Savremena poljoprivreda, Vol.44 (Vanredni broj): 45-49, Novi Sad.
Balaž Jelica, Stamenov, M. (1997): Rasprostranjenost Erwinia amylovora u Vojvodini i preporuke za njeno suzbijanje. XIX seminar iz zaštite bilja. Beograd, 10 - 11.02.1997. Rezimei referata: 33-35.
Balaž Jelica, Ognjanov, V., Stamenov, M., (1997): Erwinia amylovora na jabučastom voću u Vojvodini i mere zaštite. Biljni lekar 1: 55-60, Novi Sad
Billing Eve, Crosse, J. E., Garrett, C. M. E. (1960): Laboratory diagnosis of fire blight and bacterial blossom blight of pear. Plant Pathology 9: 19-25.
Gavrilović, V. (1998): Bakteriološke odlike sojeva Erwinia amylovora (Burrill) Wislow et al., različitog porekla. Magistarska teza, p.68. Poljoprivredni fakultet, Novi Sad. (Zaštita bilja 224: 121 - 167, Beograd).
Jovanović Gordana (1999): Rasprostranjenost, značaj i domaćini bakterije Erwinia amylovora na teritoriji južne Srbije. Magistarska teza, p. 127. Poljoprivredni fakultet, Novi Sad.
Jovanović Gordana, Arsenijević, M. (1998 a): Dosadašnja iskustva stečena na terenu u radu sa Erwinia amylovora. Jugoslovensko voćarstvo (u štampi), Čačak.
Jovanović Gordana, Arsenijević, M. (1998 b): Etiološka proučavanja izumiranja cvetova i mladara kruške. IV jugoslovenski kongres o zaštiti bilja. Vrnjačka Banja, 21 - 26.09.1998. Zbornik rezimea: 65.
Klement, Z., Rudolph, K., Sands, D.C. (1990): Methods in Phytopathology, p.568. Académiai Kiadó, Budapest,Hungary.
Kûdela, V. (1988): Erwinia amylovora - Causal Agent of Fire Blight of Rosaceous Plants in Chechoslovakia. Ochr. Rostl. 24 (3): 173-182.
Kûdela, V. (1990): Spála rú`ovitých rostlin, p.163, Min.zem.a vý` ČSR Výst. zem. a vý`ivy, České Budejovice.
Lelliott, R. A., Stead, D. E. (1987): Methods for the Diagnosis of Bacterial Diseases of Plants, p.216. Britisch Society for Plant Pathology, Blackwell Scientific Publication. Oxford, London and Edinburg.
Mitrev, S. (1993): Proučavanje bakterije Erwinia amylovora (Burrill 1882) Winslow et al. 1920 kao parazita voćaka u Makedoniji. Magistarska teza, p.71. Poljoprivredni fakultet, Novi Sad.
Mitrev, S. (1995): Patogene i bakteriološke karakteristike Erwinia amylovora parazita kruške i dunje u Makedoniji. Zaštita bilja 212: 97-109, Beograd.
Panić, M., Arsenijević, M. (1991): Erwinia amylovora (Burrill) Winslow et al. - Pojava, rasprostranjenost i štetnost u svetu i u Jugoslaviji. Glasnik zaštite bilja 6: 191-197, Zagreb.
Panić, M., Arsenijević, M. (1992): Outbreak, Spread and Economic Importance of Fire Blight Phathogen (Erwinia amylovora) in Yugoslavia. VI International Workshop on Fire Blight, October, 10-12. 1992.,Athens, Greece (Acta Horticulturae 338:89-96,1993).
Panić, M., Arsenijević, M. (1996): Bakteriozna plamenjača voćaka i ukrasnih biljaka - Erwinia amylovora. Monografska studija. Zajednica za voće i povrće, Beograd D. D. i Poljoprivredni fakultet, Novi Sad, p.413.
Panić, M., Arsenijević, M., Antonijević, D. (1994): Rasprostranjenost, domaćini i bakteriološke odlike Erwinia amylovora u Jugoslaviji. III jugoslovenski kongres o zaštiti bilja. Vrnjačka Banja, 03-07.10.1994. Zbornik radova: “Zaštita bilja danas i sutra”, ed. Šestović, M., Nešković, N., Perić, I., pp.145-159, Beograd.
Psallidas, P. G. (1990): Fire blight of Pomaceous trees in Greece. Evaluation of the disease and characteristics of the pathogen Erwinia amylovora. Acta Horticulturae 273: 25-32.
Psallidas, P. G., Dimova Maria (1986): Occurrence of the disease fire blight of Pomaceous trees in Cyprus. Characteristics of the pathogen Erwinia amylovora. Annls Inst. Phytopath. Benaki, Greece, (N. S.) 15: 61-70.
Schaad, N. W. (1980): Laboratory Guide for Identification of Plant Pathogenic Bacteria. American Phytopath. Society, St. Paul, Minnesota.
Suslow, T. W., Schroth, M. N., Isaka, M. (1982): Application of a Rapid method for Gram Differentiation of Plant Pathogenic and Saprophytic Bacteria without Staining. Phytopathology 72: 917-918.
Šutić, D., Panić, M. (1969): Metode proučavanja fitopatogenih bakterija. Zavod za zaštitu bilja Poljoprivrednog fakulteta i Sekretarijat za poljoprivredu, šumarstvo i vodoprivredu Srbije, Beograd.
van der Zwet, T., Keil, H. L. (1979): Fire Blight. A Bacterial Disease of Rosaceous Plants. U.S. Government Printing Office, Washington, D. C. 1-200.
van der Zwet, T., Beer, S. V. (1991): Fire Blight - Its Nature, Prevention and Control. A Practical Guide to Integrated Disease Menagement. U.S. Department of Agriculture. Agricultural Information Bulletin No.631, 83 pp.
Ova štetočina predstavlja najveću opasnost u plasteničkoj proizvodnji. Štetočina pričinjava primarne štete - siše sokove što izaziva pojavu slabije vitalnosti biljaka, manji porast, prirast i kvalitet plodova, kao i sekundarne štete - jer luči mednu rosu na kojoj se razvija gljiva čadjavica čime se smanjuje mogućnost procesa fotosinteze. Bela leptirasta vaš je vektor mnogih virusa. Plodovi postaju prljavi i neugledni, oštećeno lišće postepeno gubi hlorofil, nekrotira i opada.
Bela leptirasta vaš ima više od 10 generacija godišnje koje se medjusobno preklapaju. Na jednom listu nekada se može naći više od 1000 jediniki.
Suzbijanje je vrlo složeno i teško.
Moljac paradajza je izuzetno opasna, karantinska i ekonomski značajna štetočina u usevu paradajza, kada može za kratko vreme pričiniti i 100 % štetu na gajenim kulturama. Osim na paradajzu štete pričinjava na krompiru, plavom paradajzu, paprici, duvanu i pasulju, kao i na korovskim biljakama - pomoćnici, daturi i dr.
Prvi put je registrovana 1980. godine u Južnoj Americi, 2006. godine u Španiji, a potom u Italiji, Francuskoj, Grčkoj, Albaniji, Švajcarskoj, Portugaliji, Malti, Maroku, Libiji, Alžiru, 2009. godine u Turskoj, gde su registrovane vrlo velike štete i do 100 %.
Moljac je sivo braon boje dužine oko 6 mm, sa rasponom krila do 10 mm. Mužjaci su tamniji od ženki. Jedna ženka može da položi 250-260 jaja. Moljac ima 10-12 generacija tokom godine.
Reprodukuje se vrlo brzo, ciklus razvoja traje 24 - 38 dana, a zavisi od temperature. Minimalna temperatura za aktivnost je 9 0C. Tek izlegle gusenice - larve su žućkaste boje, dužine oko 0,5 mm. Kada sazrevaju postaju žutozelene. Potpuno odrasla gusenica je oko 9 mm dužine sa ružičastim ledjima i tamnom glavom. Lutke su svetlo smedje, dužine oko 6 mm.
Štete na paradajzu pričinjava larva - gusenica koja se hrani lišćem i stabljikom pri čemu pravi mine - hodnike, a unutar mina može se videti larva. Larva oštećuje i plodove, zrele i zelene. Na tako oštećenim plodovima dolazi do pojave sekundarnih parazita koji utiču na potpuno propadanje plodova koji nemaju nikakvu upotrebnu vrednost.%20004.jpg)
Suzbijanje:
- Pojačan fitosanitarni nadzor nad prometom rasada i plodova,
- Primena preventivnih mera je obavezna,
- Veliki je broj biljaka domaćina – štetočina ima sklonost prema paradajzu, ali oštećuje i krompir, plavi paradajz, papriku, duvan, pasulj, zatim korove – pomoćnicu, daturu i dr,
- Kvalitetna obrada zemljišta, iznošenje i uništavanje zaraženih biljnih ostataka nakon berbe,
- Ne koristiti i obavezno uklanjati i uništavati ambalažu u kojoj je uvežen plod ili rasad,
- Koristiti zaštitne mreže, postavljati feromonske, lovne klopke radi praćenja leta insekta,
- Suzbijanje je vrlo teško i iz razloga što ima veliki broj generacija tokom godine 10-12 generacija, a broj zavisi od temperature,
- Nema adekvatnog preparata, a zbog sukcesivne berbe povrća ne mogu se uvek primenjivati pesticidi, zbog karence, odnosno ostataka pesticida u hrani. Od hemijskih preparata preporučuju se: Vertimec, Coragen,Avaunt i dr.,
- Primena bioloških mera borbe - primena parazita, predatora, kao i insekticida biološkog porekla.





 O-Sense
O-Sense




_001.jpg)
_002.jpg)
%20003.JPG)






.jpg)















.JPG)

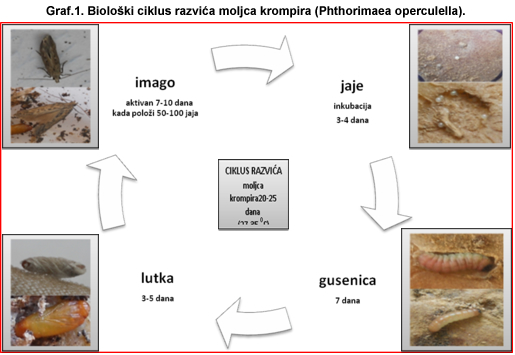




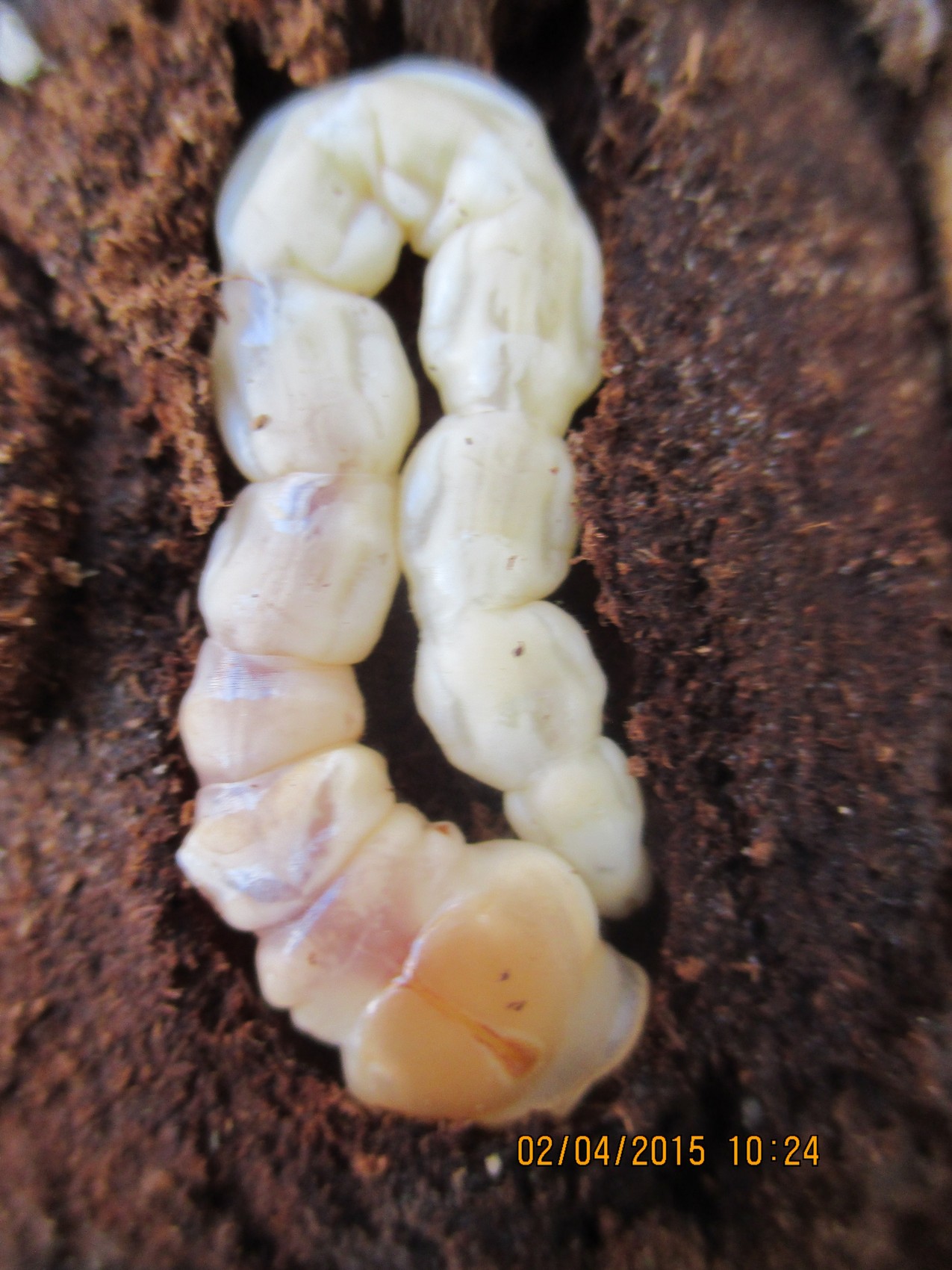
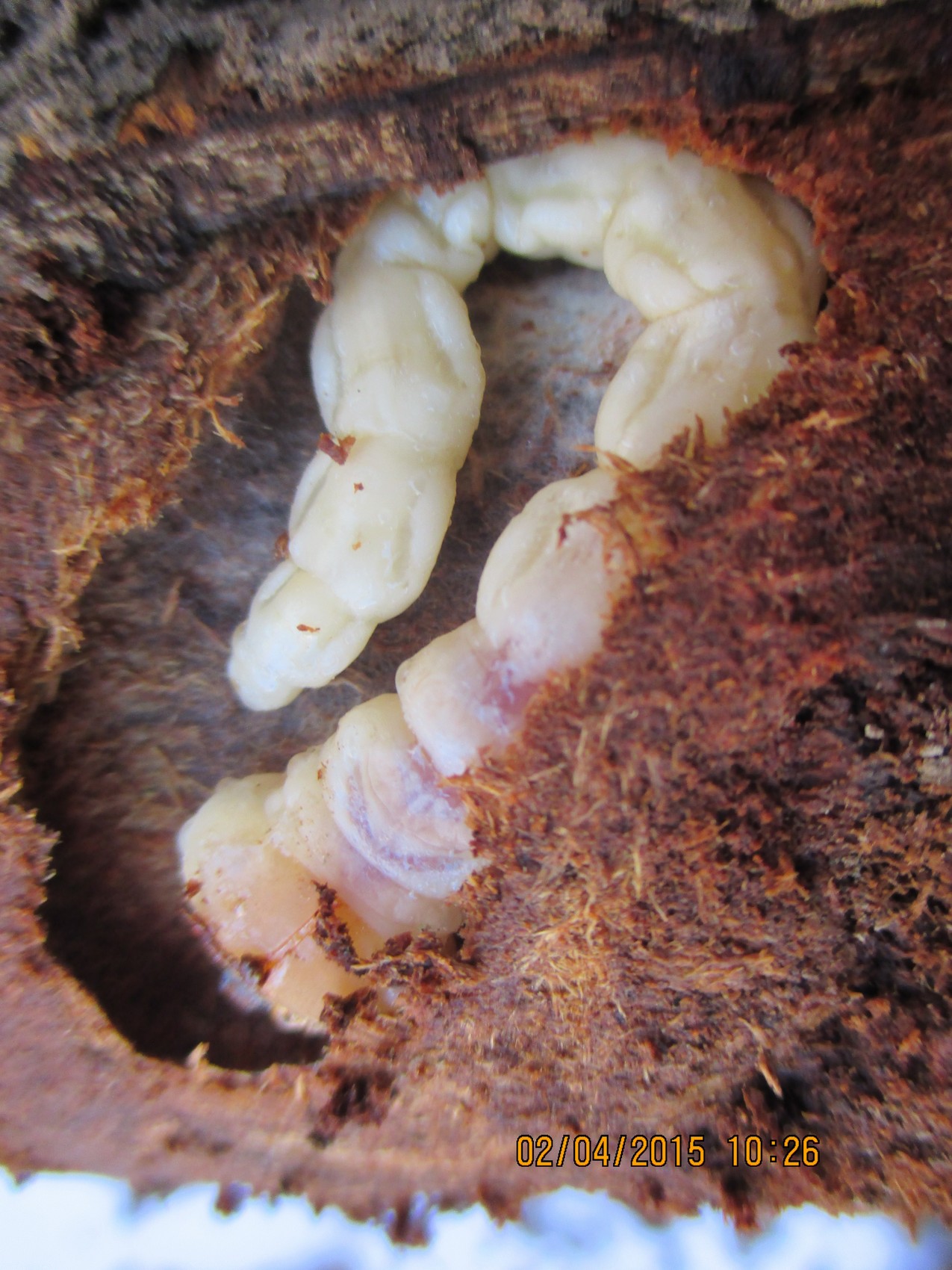






.jpg)





























.JPG)










 1.JPG)
 2.JPG)
 3.JPG)














.JPG)






 01.JPG)
 02.JPG)


 001.JPG)





_001.jpg)
_002.jpg)
_003.jpg)
_004.jpg)
_005.jpg)
_006.jpg)
_007.jpg)
_008.jpg)
_009.jpg)
_010.jpg)
.JPG)
 001.JPG)
 002.JPG)
 003.JPG)
 004.jpg)
 005.JPG)
 006.JPG)
 007.JPG)










 001.jpg)







.JPG)







.jpg)
 001.JPG)


















 001.JPG)
_001.jpg)
_002.jpg)
.jpg)





.jpg)






 001.JPG)




 001.jpg)
 001.JPG)





